中国造血干细胞移植大有可为,细胞治疗、基因治疗前景可期
健康界田新芳
造血干细胞移植是治疗血液恶性肿瘤、非恶性肿瘤等疾病的最有效手段之一,让很大一部分患者看到治愈的希望。CAR-T细胞治疗难治/复发血液肿瘤、造血干细胞基因编辑自体移植治疗地中海贫血正在进行规范的临床研究,前景可期。
中国医学科学院 北京协和医学院主办、中国医学科学院血液病医院(中国医学科学院血液学研究所)承办的第二届中国血液学科发展大会于1月15-17日盛大召开。造血干细胞移植及细胞治疗专题论坛中,北京大学人民医院张晓辉教授、中国医学科学院血液病医院姜尔烈教授分别就中国异基因及自体造血干细胞移植的现状和前景做了精彩报告。美国纽约Memorial Sloan-Kettering癌症中心Michel Sadelain教授、武汉同济医院周剑峰教授分别针对CAR-T细胞治疗技术研发及中国CAR-T细胞治疗临床研究现状和前景做了全面梳理;基因治疗技术研发、临床转化及临床研究规范开展这一热点问题,国家药品监督管理局药品审评中心生物制品临床部审评员高建超教授对于细胞治疗、基因治疗产品的研究与评价技术指导原则做了全面阐述,北京大学魏文胜教授、华东师范大学李大力教授分别对基因编辑技术研发做了前沿报告,中国医学科学院血液病医院施均教授报告了地中海贫血基因治疗1年期随访数据。
我国造血干细胞移植进入快车道,未来可期

张晓辉教授指出,中国造血干细胞移植的发展已经进入快车道,2020年登记的移植中心共170家,较2019年新增21家。自2008年以来,我国造血干细胞移植快速增长,2020年,我国自体干细胞移植3371例,异基因移植达10042例,占74.9%。新冠肺炎疫情期间,2020年各病种移植例数总体仍呈上升趋势。
在全球移植例数显著下降的情况下,我国造血干细胞移植数量逐年增长,意味着未来将有很大的发展空间。
从造血干细胞移植类型分布来看,2020年单倍体移植在异基因移植中占比最大,为62%;造血干细胞移植在急性髓系白血病(AML)、急性淋巴性白血病(ALL)、非霍奇金淋巴肿瘤(NHL)、多发性骨髓瘤和再生障碍性贫血患者中应用最广泛。
免疫及新药时代下,我国造血干细胞移植如何选择最好的治疗路径和临床模式,为患者提供最优的治疗结局?张晓辉教授认为,免疫及新药时代下,造血干细胞移植应与免疫、新药深度结合,形成更加有效的综合治疗体系,而不是追求单一治疗手段。
此外,张晓辉教授也阐述了新药联合造血干细胞移植“多重治疗”的新策略。在进行造血干细胞移植前,使用新药进行诱导桥接,促进移植前完全缓解,促进MRD阴性,改善预后;使用新药进行预处理,提高预处理方案的安全性;移植中使用新药进行维持治疗,改善无进展生存期,提高维持治疗的安全性;移植后,使用新药进行挽救治疗,促进复发后完全缓解。
 造血干细胞移植综合治疗新模式的前景
造血干细胞移植综合治疗新模式的前景
我国干细胞技术发展之路虽然曲折,但我国科学家不断改进和完善干细胞研究,突破与创新关键技术,对世界干细胞移植做出了巨大贡献。
立足自体造血干细胞移植,辐射引领多元化干细胞移植发展

中国医学科学院血液病医院姜尔烈教授介绍了自体造血干细胞移植的现状和展望。姜尔烈教授指出,2008~2020年的数据分析显示,我国自体造血干细胞移植以多发性骨髓瘤、淋巴瘤为主,未来尚有较大的发展空间。
尽管新药层出不穷,但NCCN指南及我国最新MM指南均强调了自体造血干细胞移植在MM治疗中不可取代的地位。中国成人急性淋巴细胞白血病诊断与治疗指南(2021年版)、中国成人急性髓系白血病(非急性早幼粒细胞白血病)诊疗指南(2021年版)对自体造血干细胞移植均有推荐,后者推荐级别更高。
自体造血干细胞移植具有较多的优势,如不受供体限制、移植相关死亡率低、不发生GVHD、移植并发症少等。姜尔烈教授指出,未来应开展探索性研究,充分利用新药以及新的免疫靶向治疗方法,与自体造血干细胞移植相结合,并对其作用机制进行探索,实现疾病的个体化治疗。
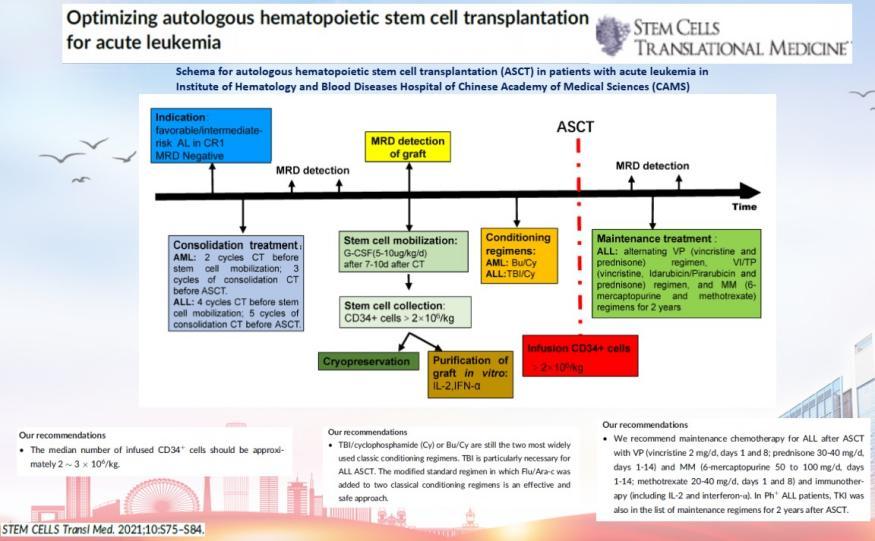
中国医学科学院血液病医院所目前自体移植患者达2000例以上,是我国开展首例自体造血干细胞移植的中心。中国医学科学院血液病医院也充分发扬了中国自体移植开创者的优势地位,牵头制定了中国自体移植诊疗规范及标准,优化自体移植预处理方案,实现疾病的个体化、分层精准移植治疗。
作为中国最大的MDS移植中心,中国医学科学院血液病医院率先构建MDS移植原创性整体体系,开展多中心临床研究,牵头制定全国诊疗规范,带动基层单位移植能力,致力于打造个体化精准分层移植整体治疗的中国模式,以专科发展带动移植水平的普遍提升。
移植物抗宿主病的基础免疫机制和靶向干预手段

移植物抗宿主病是骨髓移植后出现的多系统损害全身性疾病,是造成死亡的重要原因之一。中国医学科学院血液病医冯晓明教授介绍了移植物抗宿主病的基础免疫性机制,以及靶向干预手段。
移植物抗宿主病是由于移植后异体供者移植物中的T淋巴细胞,受到受者体内细胞因子风暴刺激,抗原T细胞引发应激反应,T细胞分化增殖,产生大量的细胞因子激活B细胞和其他免疫性细胞,产生免疫炎症反应,其中皮肤,肝及肠道是主要的靶目标。
冯晓明教授结合临床试验证据,介绍了移植物抗宿主病靶向干预的最新进展,包括药物抑制或清除自身反应性T细胞、促进调节性T细胞药物、调节性T细胞过继输注治疗以及间充质干细胞过继输注治疗。冯晓明教授指出,对于难治性/危重移植物抗宿主病,应探索更有效抑制炎症的治疗方法。Treg细胞输注治疗的效果不尽如人意,应增强Treg细胞治疗的有效性,提高功能稳定性。
细胞治疗、基因治疗前景可期
Michel Sadelain教授首先介绍了CAR-T细胞治疗的概况以及在美国获批上市的情况,随后针对如何进一步优化CAR-T细胞治疗的疗效展开论述,主要从促进CAR-T细胞功能更持久和克服抗原免疫逃逸两个方面结合自己实验室的工作进行了介绍。同时,也为大家展现了未来的细胞免疫治疗前景,相信未来会有更多新的CARs,新的细胞类型,新的应用领域,细胞免疫治疗前景可期。

周剑峰教授从ZUMA系列研究讲起,带大家一起回顾了一款CAR-T细胞产品怎样通过高质量的一系列临床试验一步一步向更前线的治疗,更多的适应症推进。同时,也结合华中科技大学同济医学院附属同济医院血液科开展的一系列临床研究,包括研究者发起的临床试验和注册类临床试验等等,展示出中国学者在CAR-T细胞领域作出的各种探索和贡献。

细胞治疗研究虽然最早从美国开始,但中国学者加速前进,与美国同行形成并跑态势。国内现在已有两款CD19 CAR-T细胞产品上市,中国医学科学院血液病医院王建祥教授团队自主研发具有独立知识产权的CD19 CAR-T细胞产品临床试验进展顺利,已被CDE列为复发难治成人急性淋巴细胞白血病的突破性疗法,更在近日获得美国FDA授予的孤儿药资格认定,用于治疗急性淋巴细胞白血病。相信随着更多细胞产品的上市,我国血液病细胞治疗将大有可为,中国原研将走向全球。
高建超教授解析了国家药监局针对细胞和基因治疗临床研究的指导原则,并详细分析了细胞基因治疗产品的特性,从临床试验的设计要点、受试者安全性及疗效评价、数据来源多样性等方面阐明审评的原则性考虑。高建超教授指出,细胞和基因治疗产品的临床试验需格外关注风险管控,应针对安全性风险的预防、识别、诊断、治疗和随访等制定全面可操作性的风险控制方案。细胞治疗产品在获准上市应用前,申办方就应该考虑到医疗机构及医务人员进行细胞治疗的能力评估和认证这一重要环节;上市后需要继续开展临床研究或长期随访研究,以进一步积累创新性细胞治疗产品的研究数据。未来,国家药监局高度重视并将持续开展细胞和基因治疗等先进生物技术产品研究的科学监管,鼓励以患者临床需求为核心的创新细胞药物研发。

在讨论环节中,专家们围绕基因编辑技术的安全性问题,在细胞治疗监管和临床转化应用方面展开了深入讨论。童春容教授首先提出了基因编辑的个体化治疗监管问题,高建超教授表示,有关基因编辑技术安全性和有效性的证据仍在积累,相关管理政策需根据新技术的发展而不断完善。魏文胜教授和李大力教授指出,新兴技术需要开放的、科学的政策支撑,做好风险管控不仅是技术研发环节首要考虑的,也是临床研究阶段必然要遵循的首要原则,只有做好监管,才有可能创造临床可应用的突破性疗法,理论技术创新是突破性疗法的驱动力。饶书权教授指出,CRISPR/Cas9基因编辑疗法临床应用中未能“绕开”干细胞移植预处理过程,期待未来体内编辑技术的突破与其在临床转化中的应用。最后,施均教授进行了讨论总结,其阐述自开展造血干细胞基因治疗临床研究以来,我们高度重视造血干细胞的克隆演变风险,并密切追踪国内外相关安全性数据报道,进而有效预防、识别和管控基因治疗的风险,推进基因治疗在临床转化应用中的长远、可持续、安全应用。
本届中国血液学科发展大会是以线上交流为主,可以通过健康界官网或APP观看专家带来的知识和智慧的碰撞。点击链接观看回放:第二届中国血液学科发展大会直播合集
或通过以下扫码观看回放,遇见更多精彩!


