双特异性抗体在研产品4大作用机制分析
作者:药链圈
双特异性抗体的靶点作用机制可以分为4类,分别是细胞桥接、双靶点阻断、双免疫细胞靶点强化协同和促蛋白复合体生成。
全球双抗在研产品以细胞桥接作用机制最热门,国内则更多布局免疫细胞靶点领域。据统计,全球在研的218款双抗产品中,研发最热门的当属细胞桥接作用机制,43%的在研产品布局于此,分别是双靶点阻断机制和双免疫细胞靶点强化协同机制的1.7倍和2.2倍,促蛋白复合体生成机制的在研产品最少。从国内情况看,除去未知作用机制的产品外,介导免疫细胞的桥接、双免疫细胞靶点强化协同2类作用机制的在研产品最多,合计占在研产品总数的60%,国内暂无促蛋白复合体生产机制的产品布局。
图:全球双抗在研产品作用机制分布
数据来源:药链圈根据公开资料整理
图:国内双抗在研产品作用机制分布
数据来源:药链圈根据公开资料整理
1.细胞桥接——介导免疫细胞识别杀伤肿瘤细胞
机体免疫系统本身就具备免疫监视功能,可以识别和清除癌变细胞,但是肿瘤细胞通过下调MHC分子表达等方式,可以逃逸免疫监视,从而在机体内快速增殖,形成病灶。
双特异性抗体的细胞桥接作用主要是引导免疫细胞识别杀伤肿瘤细胞。此类双抗在设计两条抗原结合臂时,设计成一条与肿瘤抗原结合,另一条与效应细胞(常用T细胞和NK细胞)上的抗原结合,从而达到激活效应细胞重新识别和清除肿瘤细胞的作用。CD3是目前双抗药物开发热门的免疫细胞表面靶点,具有更强的激活和招募T细胞的能力。目前已经上市的3款双抗中,Removab和Blincyto2款都是靶向CD3的细胞桥接作用机制。
图:双抗的细胞桥接作用图示
资料来源:Nature
细胞因子风暴是双抗细胞桥接机制下最大的毒副作用,主要由CD3的高亲和力和Fc介导的免疫效应造成。CD3较高的亲和力导致双抗在尚未结合肿瘤细胞时就活化T细胞,诱发细胞因子快速剧烈的释放,引发细胞因子风暴,且CD3高亲和力也会加速药物代谢,减少双抗在肿瘤内的分布,影响抗体功效。双抗的Fc结构与其他效应细胞表面的Fc受体结合,同样也会诱发细胞因子风暴。已上市的Removab虽然具有较高的疗效,但就是由于其较为严重的副作用,导致该产品在2017年退市。
因此,细胞桥接双特异性抗体的设计重点在于选择合理的抗体亲和力范围,在具有更强特异性的肿瘤靶点的同时,尽可能抑制Fc介导的效应功能。已上市的Blincyto(靶向CD3×CD19)去除了Fc结构,降低了T细胞过度活化的风险,两个抗体均采用单链抗体片段,不具备完整的IgG结构,降低了CD3亲和力。同时选择了肿瘤特异性较高的CD19靶点,安全性相对较好。
图:国内采用细胞桥接机制的在研双抗
数据来源:药链圈根据公开资料整理
2.双靶点阻断——降低肿瘤逃逸可能性及克服耐药性
在细胞增殖过程中,受体酪氨酸激酶(RTKs)发挥重要调节作用,其在肿瘤细胞表面的异常表达会导致肿瘤细胞恶性增生。RTK抑制剂通过对受体酪氨酸激酶活性(可逆或不可逆)的抑制,阻断细胞表面受体与配体结合后胞内区活化信号,从而达到抑制肿瘤细胞生产的作用。但是,肿瘤细胞可以通过补偿信号通路或同靶点不同表位之间的同源或异源二聚体激活细胞内信号进行逃逸或产生耐药性。
双特异性抗体的双靶点信号通路机制,是通过同时靶向两个或多个RTKs或其配体,和同时阻断两个或多个信号通路的方式,来减少肿瘤细胞逃逸和克服耐药性。
图:双抗的双靶点信号通路阻断作用机制图示
资料来源:Nature
根据不同靶点选择,双抗的双靶点阻断机制可以分为三类:
一是补偿通路阻断。以非小细胞肺癌为例,10%-15%的非小细胞肺癌患者会发生EGFR突变,临床上会使用第一代和第二代EGFR抑制剂治疗,患者发生EGFR二代变异(T790M突变),出现一代和二代抑制剂耐药后,第三代EGFR抑制剂(奥西替尼)用来治疗二代突变患者,但EGFR的C797S突变以及c-met突变会导致奥西替尼的耐药,而目前尚无治疗三代抑制剂耐药的小分子药物。设计为靶向EGFR×c-Met的双抗药物,如强生的Amivantamab、岸迈生物的EMB-01,在临床试验中体现出对于奥西替尼耐药患者的疗效,有望成为第三代EGFR抑制剂耐药后的治疗选择。
二是不同表位阻断。以靶向HER2的药物赫赛汀(曲妥珠单抗)为例,赫赛汀能竞争性结合HER2受体,阻断下游通路激活,但大部分初始接受赫赛汀治疗有效的病人常在短期内出现耐药,主要原因是尽管阻断了HER2通路,但HER2仍可以和其他家族成员(HER1、3、4)形成二聚体激活下游通路。HER2×HER2双抗的设计,是通过同时结合两个非重叠的HER2表位,实现对于HER2信号通路的更完整的阻断。目前国内基于该机制的在研产品主要有康宁杰瑞的KN026、天广实的MBS301、百济神州与Zymeworks合作的ZW25等。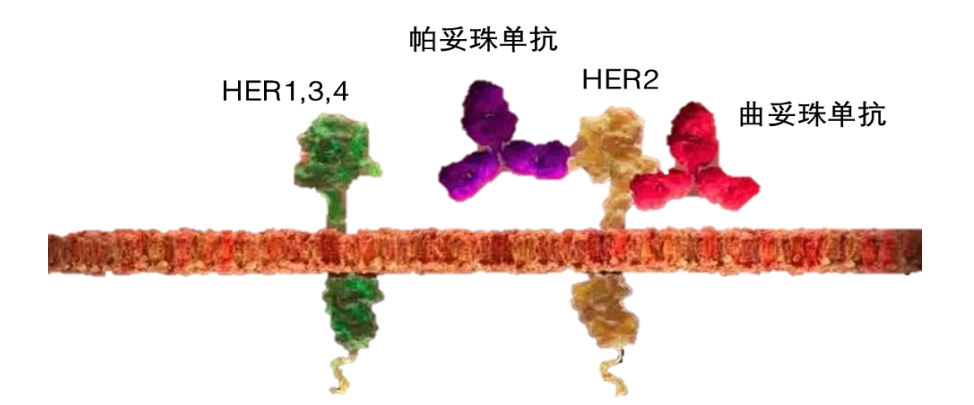
图:双表位阻断实现HER2信号通路更完整的阻断
资料来源:药链圈根据公开资料整理
三是靶向肿瘤生长环境。肿瘤的生长需要血管供给营养以及微环境抑制免疫细胞,抗血管生成通过同时阻断两个或多个血管生成的通路,如VEGF、VEGFR等,增强抗血管生成的效果,使肿瘤细胞缺乏氧气和营养而凋亡。此外,肿瘤会通过表达免疫抑制因子和招募免疫抑制细胞等方式,实现免疫逃逸。为增强免疫治疗效果,部分双抗被设计用来抑制肿瘤微环境,增强免疫细胞杀伤。
脱靶毒性是双抗药物的双靶点阻断机制下最值得关注的毒副作用。在肿瘤治疗中,由于部分抗原不止表达于肿瘤细胞,也会在机体正常细胞上表达,因此双靶点信号阻断作用机制下,可能会杀伤表达相应抗原的正常细胞,造成与治疗相关的不良反应,存在脱靶毒性。
因此,寻找具备较强肿瘤特异性的靶点、选择具有协同作用的两个靶点是该机制下双抗设计的关键,难点和重点在于调节两个靶点之间的亲和力以及空间距离,使双抗结构能够同时阻断两个信号通路,达到杀伤效果。
图:国内采用双靶点信号通路阻断机制的在研双抗
数据来源:药链圈根据公开资料整理
3.双免疫细胞靶点强化协同机制——改善单药毒性较大及无响应问题
随着免疫疗法的研发推进,以靶向PD-1、PD-L1、CTLA-4等免疫检查点的单抗药物已经成为肿瘤治疗的重要手段,但免疫检查点单抗药物的临床效果仍有限,患者的应答率仍较低。免疫检查点单抗的联合疗法已经在多个临床试验中展现出强于单药的治疗效果。因此,以联合用药产生的协同效应为理论基础,靶向2个免疫细胞表面抗原的双抗药物成为研究热点。
图:双抗的双免疫细胞靶点强化协同作用机制图示
资料来源:Nature、BCG
按照靶点机制可以分为2类:
一是作用于2个免疫检查点。例如,靶向CTLA-4的伊匹木单抗由于较大的细胞毒性,在临床的应用受限。通过设计高PD-1亲和力和低CTLA-4亲和力的双抗,能保障药物在促进浸润PD-1/CTLA-4双阳性淋巴细胞激活的情况下,减少CTLA-4对外周T细胞的结合,提高临床安全性。目前国内在研产品主要由康宁杰瑞的KN046、康方生物的AK104和齐鲁制药的PSB205等。
二是作用于1个免疫检查点和1个免疫活化靶点。例如,靶向免疫活化靶点4-1BB的免疫激活剂,单药使用时会出现严重的肝毒性,此前在单抗研发上受阻。在双抗中通过设计成上端是PD-L1下端是4-1BB的4价抗体,使双抗要先与PD-L1结合产生触合效果后才能激活4-1BB,因此在临床上表现出相比于4-1BB单药明显降低的肝毒性。典型的在研产品如科望生物引进的ES101和信达生物的IBI319。
图:靶向PD-1、4-1BB的双抗设计
资料来源:科望生物官网
图:国内采用双免疫细胞激活机制的在研双抗
数据来源:药链圈根据公开资料整理
4. 促蛋白复合体生成
利用双特异性抗体的两个抗原臂可以结合不同抗原的特点,将双抗设计成可以结合两种特定蛋白分子,使之形成功能性复合体,替代缺失的功能性蛋白发挥作用。
例如已上市的用于治疗血友病的双抗Emicizumab。血友病是凝血因子VIII缺陷性疾病,由于凝血因子VIII缺失,导致无法将凝血因子IXa和凝血因子X连在一起,促进凝血因子IXa对凝血因子X的激活,从而造成机体出血。Emicizumab被设计成可以靶向桥连凝血因子IXa和凝血因子X,通过模拟替代凝血因子VIII,促进凝血酶的产生,降低血友病患者的出血率。
图:双抗的促蛋白复合体生成作用机制图示
资料来源:Nature

人点赞

人收藏

打赏














 010-82736610
010-82736610
 股票代码: 872612
股票代码: 872612
 京公网安备 11010802020745号
京公网安备 11010802020745号











