国内以卡替医疗为代表的企业正处于TIL疗法的第一梯队,相信随着技术不断成熟,会有更多企业参与到TIL疗法的研发工作之中。
欢迎关注凯莱英药闻公众号
过继T细胞疗法(adoptive T-cell therapy,ACT),主要包括嵌合抗原受体(CAR-T)、T细胞受体(TCR)和肿瘤浸润淋巴细胞(TIL)三种疗法。近年来,该领域随着多款CAR-T产品相继上市迎来了高光时刻,相关明星产品因其优异的临床表现已成为多种血液肿瘤的替代治疗方法。然而,由于特异性细胞表面靶点等因素限制,CAR-T相关技术在实体瘤领域内进展较慢。于此同时,TIL疗法在实体瘤领域内表现出了巨大的潜力。
本文将重点介绍TIL疗法的前沿产品lifileucel。
No.1 TIL疗法
肿瘤浸润淋巴细胞(Tumor-infiltrating lymphocytes,TILs)是肿瘤组织中的浸润淋巴细胞。在肿瘤患者体内,TIL细胞受到PD-L1等免疫因子的抑制或T细胞耗竭等机制的影响,对肿瘤细胞的杀伤能力逐渐下降。以皮肤黑色素瘤为例,TIL就存在下图中的三种浸润模式:(A)缺失:肿瘤内无淋巴细胞或肿瘤本身无浸润;(B)不活跃:淋巴细胞分散在一个或多个病灶中;(C)活跃:淋巴细胞在整个肿瘤垂直生长期的弥漫性浸润。
TIL细胞在皮肤黑色素瘤中三种典型浸润模式
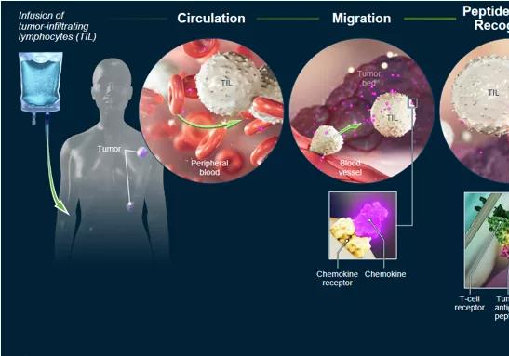
TIL疗法通过患者体内提取含TIL细胞的肿瘤组织,经体外分离、筛选、扩增后,将其回输至患者体内,实现对肿瘤的特异性杀伤作用。TIL细胞进入患者体内后随血液循环到达肿瘤部位,通过释放干扰素(如IFN-γ)、颗粒酶(Granzyme)、穿孔素(Perforin)等实现杀伤肿瘤细胞的效果。
由于TIL从患者体内分离后并未经过基因改造,因此不良反应相对较少。除此以外,相较于CAR-T疗法,TIL疗法还具有可针对多种肿瘤抗原、非肿瘤组织靶向效应较少等特点。
三种细胞疗法对比
在TIL制备技术发展的早期,只有分离、扩增和回输三个阶段。随着研究的深入,在扩增前增加了筛选步骤,大大提高了TIL的有效性。TIL制备的一般过程如下:
医生首先通过手术获得新鲜的肿瘤组织(大于1cm3),提取并克隆不同类型的T淋巴细胞,并将其与白细胞介素-2(IL-2)一起培养。T淋巴细胞在IL-2的刺激下增殖形成细胞群;
通过外显子筛选等技术完成对TIL细胞筛;
筛选得到的肿瘤特异性TIL进一步扩增;
患者接受化疗以减少体内已有淋巴细胞的对生长因子的竞争,并且清除其它抑制T细胞功能的细胞,比如调节性T细胞(Treg)等;
TIL细胞回输至患者体内。
No.2 lifileucel
lifileucel是Iovance Biotherapeutics利用引进自美国国立卫生研究院(NIH)的TIL技术开发的自体细胞疗法。根据工艺模式、TIL细胞培养扩增时间和体外筛选手段的不同可分为LN-144(第三代工艺生产,16天)、LN-145(第二代工艺生产,22天)和LN-145-S1(PD-1选择性筛选)。
以LN-145的第二代工艺为例,TIL细胞来源自皮肤、淋巴结、肝、肺、腹膜、肌肉骨骼、乳腺等器官。经体外培养22天及细胞筛选后(约有1x109–150x109个TIL细胞),回输至经过非清髓性淋巴清除(NMA-LD)化疗的患者体内。随后患者接受IL-2注射,以促进TIL细胞在体内的存活和扩散。
lifileucel疗法覆盖原发性Ⅳ期转移性黑色素瘤、转移性宫颈癌、转移性头颈鳞状细胞癌(HNSCC)和晚期非小细胞肺癌(NSCLC)等实体瘤,相关管线为已完成或正处于临床II期阶段。
目前,除lifileucel外,全球有多项TIL管线正处于临床试验阶段(临床II期5个,临床I期2个):
全球临床II期TIL管线情况
No.3 临床表现
目前,Iovance Biotherapeutics已公布了多项临床试验的关键数据结果:
转移性黑色素瘤
2015年9月,一项开放标签、多中心、前瞻性、单组分配、介入性、单臂、II期临床试验(NCT02360579)在美国启动,以评估LN-144联合IL-2治疗转移性黑色素瘤的疗效。
试验结果显示,66例患者平均接受3.3次既往治疗,且全部接受过PD-1或PD-L1治疗治疗。ORR为36%(95%CI,25~49),2例完全缓解(CR),22例部分缓解(PR)。疾病控制率为80%(95%CI,69~89),见下图左。在抗PD-1或PD-L1治疗的原发性难治亚组中,ORR和疾病控制率分别为41%(95%CI,26~57)和81%(95%CI,66~91)。在可评价的患者中,50例(81%)在接受治疗后肿瘤负担减轻,见下图右。
宫颈癌
2017年4月,一项开放标签、多中心、单臂、介入性、II期临床试验(NCT03108495)在美国启动,以评估LN-145对治疗复发和/或转移性宫颈癌患者的安全性、耐受性和疗效。
试验结果显示,27名患者接受了LN-145疗法,平均回输了28x109的TIL细胞,ORR为44.4%,其中3例完全缓解(11.1%),9例部分缓解(33.3%)。不良反应事件与已知的NMA-LD和IL-2造成的不良反应相似。
HNSCC联合K药
2018年10月,一项非随机、平行分配、开放标签的II期临床试验(NCT03645928)启动,以评估LN-145与pembrolizumab(K药)联合治疗晚期不可切除或转移性黑色素瘤、晚期头颈部鳞状细胞癌(HNSCC)和转移性非小细胞肺癌(NSCLC)患者的疗效和安全性。试验结果显示,HNSCC 适应症方面,ORR为44%,其中完全缓解率为11%,部分缓解率33%。
NSCLC联合O药
2017年10月,Iovance参与了Moffitt cancer center赞助的一项开放标签、单组分配的I期试验(NCT03215810),评估联合TILs疗法和PD-1检查点抑制剂(nivolumab,O药)治疗晚期NSCLC患者(预期n=18)的安全性和疗效。
试验结果显示,ORR为25%,其中完全缓解率为17%,部分缓解率8%。
尽管TIL疗法在研管线数量较少,但lifileucel优秀的临床试验结果已给该领域内注入了一针“兴奋剂”。国内以卡替医疗为代表的企业正处于TIL疗法的第一梯队,相信随着技术不断成熟,会有更多企业参与到TIL疗法的研发工作之中。
版权说明:本文来自凯莱英,感谢关注、转发。欢迎媒体/机构转载,转载请注明来自“凯莱英药闻”。
不感兴趣
看过了
取消

人点赞

人收藏

打赏
不感兴趣
看过了
取消






您已认证成功,可享专属会员优惠,买1年送3个月!
开通会员,资料、课程、直播、报告等海量内容免费看!

打赏金额
认可我就打赏我~
1元 5元 10元 20元 50元 其它
打赏作者
认可我就打赏我~
扫描二维码
立即打赏给Ta吧!
温馨提示:仅支持微信支付!
已收到您的咨询诉求 我们会尽快联系您
