
近年来细胞治疗产品的临床应用和规模化生产逐渐起步,本文旨在整合政策资源和文献资源,梳理细胞治疗产品的开发全流程。
细胞治疗产品(包括药品和医疗技术)为一些严重及难治性疾病提供了新的治疗思路与方法,具有广阔的应用前景和巨大的市场价值。细胞治疗是指将人自体、异体或异基因来源的活细胞经体外操作或处理后,用于患者疾病治疗的过程。近年来细胞治疗产品的临床应用和规模化生产逐渐起步,本文旨在整合政策资源和文献资源,梳理细胞治疗产品的开发全流程。
目前,细胞治疗产品的开发路径有两种:一是申请为细胞制剂,按照药品管理相关法规进行研发和注册申报,由国家药品监督管理局(NMPA)按照药品进行监管,申报和审批后再进行临床试验;二是申请为医疗技术,由国家卫健委进行备案监管,备案通过后再进行临床研究。
细胞治疗产品开发最全流程图
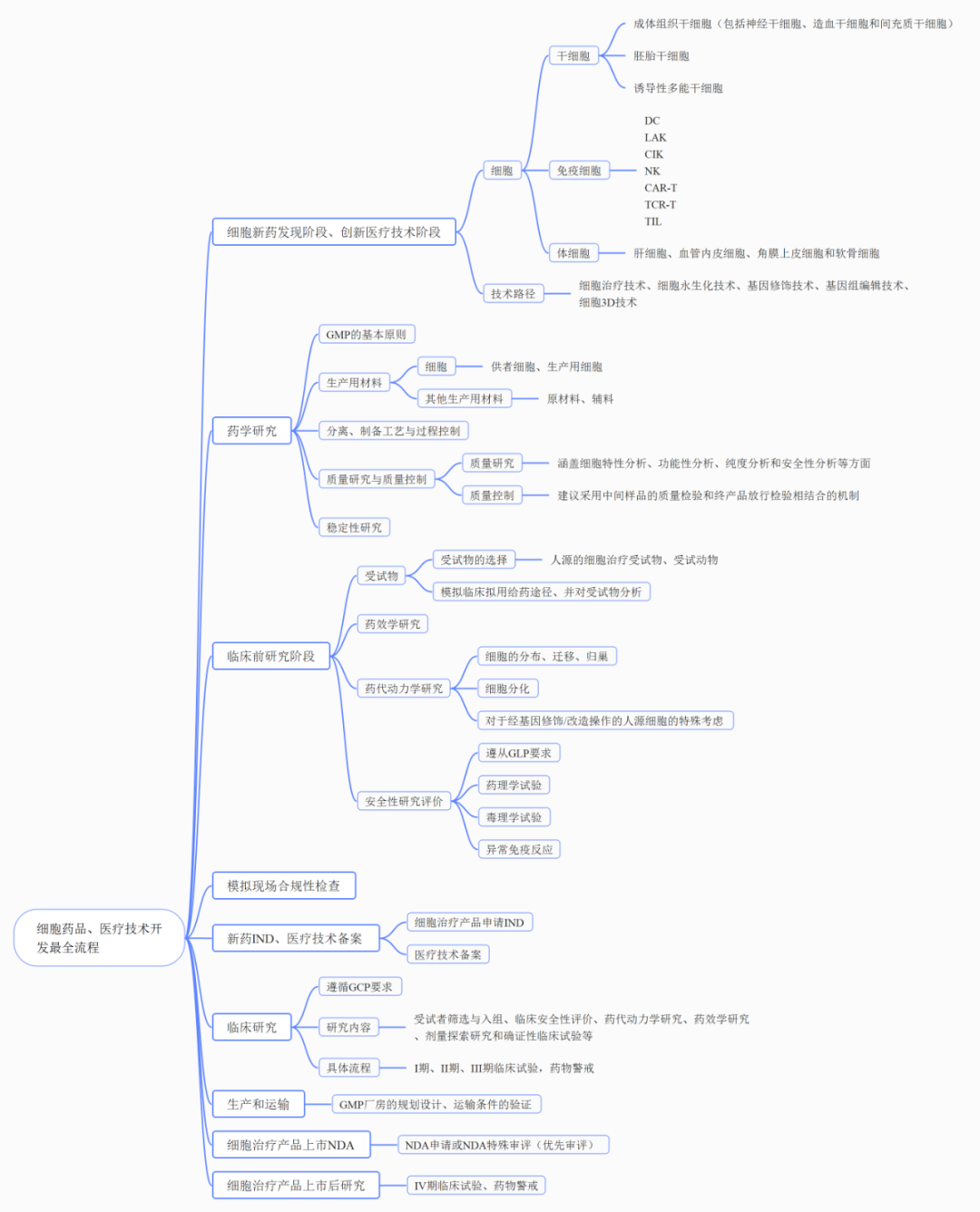
(兴德通制图)
1细胞新药发现阶段、创新医疗技术阶段
1.1 细胞治疗产品(药品、医疗技术)可选择哪些细胞进行研发?
根据细胞类型,细胞治疗可分为干细胞治疗、免疫细胞治疗、体细胞治疗。干细胞(前体细胞),包括成体组织干细胞(包括神经干细胞、造血干细胞和间充质干细胞)、胚胎干细胞和诱导性多能干细胞等;免疫细胞包括DC、LAK、CIK、NK、CAR-T、TCR-T、TIL等;成体细胞包括肝细胞、血管内皮细胞、角膜上皮细胞和软骨细胞等;
根据细胞来源,细胞治疗可分为自体细胞治疗、异体细胞治疗。
1.2 细胞治疗产品(药品、医疗技术)可采用哪些技术路径进行研发?
细胞治疗有多种技术路线,如体细胞治疗技术、细胞永生化技术、基因修饰技术、基因组编辑技术、细胞3D技术等。除了新发现和创造的技术外,组合和运用不同的技术也可以优化和改善细胞产品的质量,还可以解决临床相关不良反应。
研究机构或申请人基于细胞治疗的技术路径,选择适合的细胞或者适合的适应症,进行细胞治疗产品或医疗技术的研究,以及进行细胞治疗产品的生产。
2药学研究
临床用细胞样品的生产全过程应当符合《药品生产质量管理规范》(GMP)的基本原则和相关要求。
2.1 生产用材料
包括细胞(供者细胞、生产用细胞)和其他生产用材料(原材料:采用已经获得批准用于人体的或符合药典标准的原材料、对生物来源的原材料应进行全面的外源因子检测;辅料:宜优选经批准可用于人体的辅料)。
2.2 分离、制备工艺与过程控制
制备工艺:从供者获得供者细胞到细胞成品输入到受者体内的一系列体外操作的过程
生产工艺全过程的监控:包括生产工艺参数的监测和过程控制指标的达成等
2.3 质量研究与质量控制
质量研究:涵盖细胞特性分析、功能性分析、纯度分析和安全性分析等方面,根据产品的自身特性可再增加其他相关的研究项目。
质量控制:建议采用中间样品的质量检验和终产品放行检验相结合的机制
2.4 稳定性研究
应进行干细胞制剂在储存(液氮冻存和细胞植入前的临时存放)和运输过程中的稳定性研究。
支持细胞治疗产品的保存条件与存放期
3临床前研究阶段
3.1 选择合适的受试物
受试物的选择:人源的细胞治疗受试物、受试动物
模拟临床拟用给药途径、并对受试物分析。
3.2 药效学研究
3.3 药代动力学研究
1.细胞的分布、迁移、归巢
2.细胞分化
3.对于经基因修饰/改造操作的人源细胞的特殊考虑
3.4 安全性研究评价
1.遵从GLP要求
2.药理学试验
3.毒理学试验
4.异常免疫反应
4模拟现场合规性检查
5新药IND、医疗技术备案
细胞治疗产品IND:药品注册申请人向国家药品监督管理局申请IND,审批后进行临床试验。
医疗技术备案:机构将备案材料由省级卫健委行政部门会同药监局监管部门审核后向国家卫健委与国家药品监管总局备案,备案通过后进行临床研究。其中,干细胞临床研究在干细胞临床研究备案机构(机构应向国家卫健委与国家药品监管总局备案)开展。依据《干细胞临床研究管理办法(试行)》开展干细胞临床研究后,如申请药品注册临床试验,可将已获得的临床研究结果作为技术性申报资料提交并用于药品评价,但按照该办法完成的干细胞临床研究,不得直接进入临床应用。由医疗机构研发、制备并在医疗机构内开展的体细胞治疗临床研究和转化应用要依据《体细胞治疗临床研究和转化应用管理办法(试行)》开展。
6临床研究
细胞治疗产品的临床研究应遵循《药物临床试验质量管理规范》(GCP)的要求。
细胞治疗产品和医疗技术的临床试验:研究内容包括受试者筛选与入组、临床安全性评价、药代动力学研究、药效学研究、剂量探索研究和确证性临床试验等,具体流程包括I期、II期、III期临床试验。临床研究中还需考虑药物警戒研究。
7生产和运输
细胞制剂的规模化生产和运输:GMP厂房的规划设计、运输条件的验证。
8细胞治疗产品上市NDA
NDA申请或NDA特殊审评(优先审评)。
9细胞治疗产品上市后研究
IV期临床试验、药物警戒研究。
国务院办公厅2021年6月11日发布《关于印发国务院2021年度立法工作计划的通知》,明确提出将制定《生物医学新技术临床研究和转化应用管理条例》。干细胞技术临床研究和转化应用将依据该条例的有关规定进行管理。
兴德通细胞临床研究中心提供涵盖细胞药物研发的全产业链服务,包括细胞GMP厂房规划设计、供者筛选、分离制备工艺、质量检测和质量研究(包括特性研究和稳定性、有效期研究,提供快速检测方法)、临床前研究(包括细胞水平和动物水平的毒理学、药理学、药代动力学研究)、模拟现场合规性检查、(备案)IND申报、临床试验(临床药理学研究、临床药效学研究、I期到III期临床试验、药物警戒)、上市后研究(IV期临床试验、药物警戒)等研发全过程的咨询与服务。
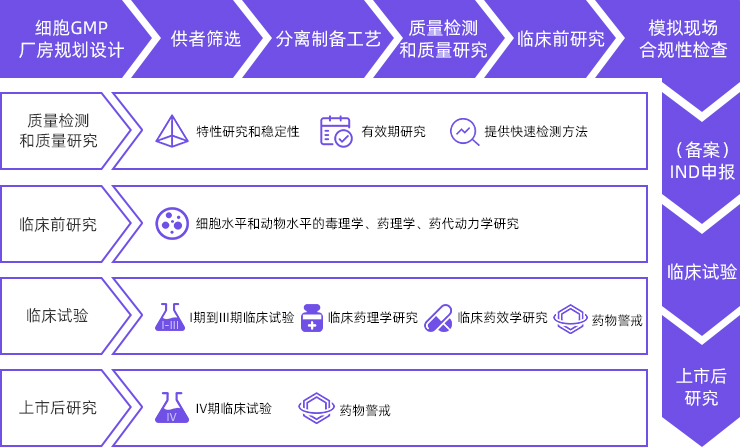
兴德通细胞临床研究中心还提供细胞制剂申报医疗技术的临床研究服务,帮助机构或研究者专业高效地进行临床研究。
参考资料:
1.干细胞临床研究管理办法(试行),2015
2.干细胞制剂质量控制及临床前研究指导原则(试行),2015
3.细胞治疗产品研究与评价技术指导原则(试行),2017
4.《体细胞治疗临床研究和转化应用管理办法(试行)》,2019
5.徐道俊,细胞治疗产品安全性的研究进展,药物生物技术,2020,27(1):82~87
6.国务院办公厅关于印发国务院2021年度立法工作计划的通知,2021
不感兴趣
看过了
取消

人点赞

人收藏

打赏
不感兴趣
看过了
取消






您已认证成功,可享专属会员优惠,买1年送3个月!
开通会员,资料、课程、直播、报告等海量内容免费看!

打赏金额
认可我就打赏我~
1元 5元 10元 20元 50元 其它
打赏作者
认可我就打赏我~
扫描二维码
立即打赏给Ta吧!
温馨提示:仅支持微信支付!
已收到您的咨询诉求 我们会尽快联系您
