晶体或结石的其他固体成分与细胞或肾组织相互作用的作用是复杂的。
Interaction of Stone Components with Cells and TissuesCite this chapter
Kleinman, J.G. (2010). Interaction of Stone Components with Cells and Tissues. In: Rao, N., Preminger, G., Kavanagh, J. (eds) Urinary Tract Stone Disease. Springer, London. https://doi.org/10.1007/978-1-84800-362-0_6
结石成分与细胞和组织的相互作用
本章回顾了结石形成材料与细胞和组织的相互作用。检查了草酸钙和磷酸钙的管内和间质位置的证据;后一种矿物特别提到了它在兰德尔斑块中的外观。讨论了晶体表面粘附和成核的机制,以及肾小管上皮细胞内化晶体及其进一步加工的证据。回顾了晶体-细胞相互作用的细胞后果,特别是刺激细胞分裂和引发多种细胞损伤或死亡。还涵盖了晶体-细胞相互作用的特异性。这包括讨论负责报告的特异性的培养细胞的特征和负责晶体粘附的细胞表面上表达的分子,特别强调一水草酸钙 (COM) 的情况。还审查了有关其他结石形成晶体(尿酸、透磷石和磷灰石)的上述现象的少量证据。还讨论了细胞或组织损伤是否会导致结石形成的问题;特别是关于草酸盐毒性作用的大量数据,以及关于高钙尿症、高磷酸盐尿症和高尿酸尿症的可用信息量较少。
1简介
肾结石病的症状需要与肾组织相互作用。肾结石要么自发排出,要么因泌尿道阻塞而产生疼痛。然而,最初形成的晶体材料似乎具有微观尺寸。本章将介绍晶体或其他固体无定形材料与肾组织或细胞的相互作用。我将考虑这些固体的附着位点、这种材料内化到细胞中以及它们通过组织的传递、细胞和组织对此过程的反应,以及这种粘附的机制。介绍的大部分材料将来自对草酸钙晶体的研究。在适当的情况下,其他主要结石晶体或固体、尿酸、尿酸、并且将指出各种磷酸钙。本章末尾将单独回顾关于这些其他物质的有限信息。最后,我将检查草酸盐、钙、磷酸盐和尿酸诱导肾小管细胞改变从而促进晶体粘附的证据。本章最后以石头形成假设的形式对材料进行了综合。
2水晶附着点
或多或少有序的结石成分的沉淀物可能通过尚待描述的机制在细胞外、间质位点形成。 1 然而,人们可以从经常引人注目的结晶尿中推断出晶体几乎肯定也会在管状流体中形成。这可能在游离溶液中、溶液微环境中或管状流体中的颗粒上自发发生。 2 , 3 晶体形成也可以发生在肾小管或膀胱壁中可能存在的表面上,无论是正常细胞、异常细胞还是由于病理过程而导致细胞剥蚀的区域。 4 , 5
2.1间质钙化和兰德尔斑块
磷酸钙的间隙沉淀导致兰德尔斑块现象。 1 这些结构已被提议作为形成特发性草酸钙结石的平台;然而,它们演变成临床结石,至少基于对结石附着部位的显微镜分析,似乎主要不涉及组织相互作用。 6 磷酸钙沉积物最初是如何形成的尚未直接解决,但从其他部位发生的钙化的考虑,有一些关于这可能如何成为可能的概念。间质部位的磷酸钙沉淀正常发生在骨骼中,病理性地发生在血管和关节中。图 6.1 显示了肾脏 Randall 斑块中的羟基磷灰石沉积,并且类似的沉积物出现在动脉粥样硬化的动脉中。 7
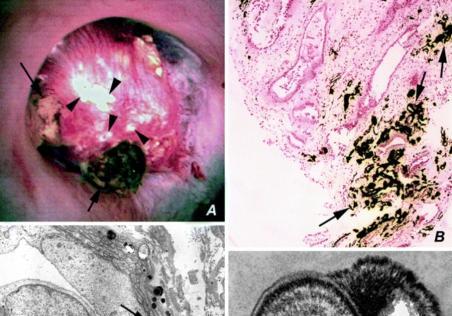
图 6.1
粥样斑块中的兰德尔斑块和钙化基质囊泡。前 4 个面板 (A-D)显示了特发性草酸钙结石形成中的兰德尔斑块图像(由 A. Evan 提供)。图 A 显示了经皮肾镜取石术期间拍摄的乳头图像。可以看到几个附着的结石(箭头),它们被一大片白色、不规则的尿路上皮下 Randall 斑块(箭头)包围。图 B 是乳头状活检标本的光学显微图像,显示间质空间中钙沉积的 Yasue 阳性部位(箭头)。面板 C 显示单个沉积物(箭头) 大小不一,位于 Henle 细环的基底膜中;面板 D 显示了在更高放大倍率下看到的单个沉积物,以显示这些结构的多层性质。电子致密层由基质材料组成,而电子透明层包含羟基磷灰石晶体。底部 8 个面板 (A-H)显示了动脉粥样硬化斑块纤维帽中钙化基质囊泡的电子显微镜检查。两种囊泡中的沉积物均被鉴定为磷酸钙(经 Blackwell Publishing, Inc. 许可,转载自 7 )
在所有这些部位,钙化都与称为基质囊泡的小膜结合结构的存在有关。这些似乎充当磷灰石结晶的起始位点。该领域的研究人员已经证明,与基质囊泡相似(如果不相同)的膜结合残余物在体外由凋亡的血管平滑肌细胞释放,并且似乎充当钙晶体形成的成核结构。 8 同一组已经证明,暴露于高浓度的钙和无机磷酸盐会诱导血管平滑肌细胞死亡和凋亡小体释放以及活细胞中基质囊泡的释放。 9
在关节软骨中,钙可能在膜结合结构内沉淀。 10 这些被称为基质囊泡,钙沉淀为焦磷酸盐,这是通过核苷三磷酸焦磷酸水解酶(一种富含于囊泡中的酶)的作用介导的焦磷酸盐生成的结果。当然,焦磷酸盐是磷酸钙和草酸钙成核的强抑制剂。 11 , 12 关节软骨基质囊泡也可以产生羟基磷灰石。 13 关节软骨基质囊泡是完全钙化还是产生钙(焦磷酸盐或磷酸钙)似乎取决于焦磷酸盐与磷酸盐的比例以及钙与磷脂的比例。 14 反过来,这些比率可能由产生无机磷酸盐的组织非特异性碱性磷酸酶与产生焦磷酸盐的焦磷酸二酯酶的相对活性以及膜联蛋白的囊泡含量决定 - 一类化合物将在稍后出现具有水晶附着力。 15 结石形成者的焦磷酸尿排泄率可能较低,这表明平衡可能向碱性磷酸酶转移。
最初,磷酸钙存在于膜结合的囊泡中。这些囊泡似乎会聚结并失去它们的膜涂层。然后沉积物侵蚀组织,并通过与间质或含流体空间的相互作用引起生物反应。
2.2晶体的表面粘附或成核
几种晶体可以直接从过饱和溶液中成核,无论是在细胞外基质成分上、在细胞碎片上还是在完整细胞上。
Gill 利用插入导管的大鼠膀胱来研究表面上的晶体形成。 17 在存在过饱和草酸钙溶液的情况下,他和他的同事只观察到暴露于 HCl 或清洁剂的膀胱中的粘附晶体。没有详细研究哪些结构或哪些结构附有晶体的问题;观察到多晶块附着在多层尿路上皮上,而不是附着在细胞已脱落的膀胱区域。有先见之明,研究人员假设附着可能是由糖萼的丢失或受损细胞存在的一种或多种附着因子介导的。
图 6.2
草酸钙晶体的内化。上图通过扫描电子显微镜显示二水草酸钙的内化(经 Springer Science + Business Media 许可从 21 重印。下图通过透射电子显微镜显示COM内化成膜结合结构(经 22 许可重印,版权所有 1994 National美国科学院)
Khan 和同事也进行了类似的研究。 18 特别是,他们发现 HCl 或 Triton 损伤的膀胱显示出草酸钙对细胞裸露区域的粘附性增加。去污剂处理的膀胱沿细胞裸露的表面显示出强烈的纤维蛋白染色;在 HCl 损伤的膀胱中染色是可变的。从这些研究以及之前讨论的 Evan 及其同事的观察中得出的结论似乎是公平的,草酸钙晶体既能够直接成核,又能够粘附到细胞或细胞外基质上。
已显示细胞外基质的某些成分粘附在晶体上。要么形成其基质的组成部分,要么调解附件。我将在下面详细说明这些细胞外基质成分是否介导肾间质内的附着,与肾小管细胞基底膜或顶端细胞膜(它们通常被排除在外)相关。
使用涉及草酸蒸气扩散的创新技术,Lieske 和同事证明了直接成核,然后通过该小组也广泛研究的过程将草酸钙晶体内化。 5
3水晶附着的后果
取决于施加的剪切力,石头成分晶体可能会从表面上洗掉,或者它们可能会长时间粘附在表面上。从它们暂时粘附的表面上洗掉的晶体最终会进入尿液,并且在临床上通常没有什么影响。事实上,这可能是尿液中形成的大多数晶体的命运,因为结石形成者的许多亲属以及正常个体都表现出草酸钙或磷酸钙结晶尿。 19 , 20 长时间粘附的晶体可能是临床结石形成的病灶。如以下部分所述,几个小组报告了晶体和细胞之间更复杂的相互作用,特别是内化、溶解和转胞吞作用。
3.1晶体内化
晶体可以通过与应用于某些晶体表面的细胞过程相互作用而被内化,然后完全吞噬晶体,以便到 24 小时在细胞质膜下观察到一些晶体(图 6.2 )。 21 在使用扫描电子显微镜的研究中,显示晶体首先粘附在顶端微绒毛上。 22 然后这些微绒毛在晶体表面上迁移并似乎合并,导致晶体迁移到细胞质膜下方。通过透射电子显微镜,显示细胞内晶体保留在膜结合的囊泡内。据报道,增加内化的因素是血清、暴露于低钾培养基、表皮生长因子和二磷酸腺苷。 23 Tamm-Horsfall 糖蛋白、精氨酸-甘氨酸-天冬氨酸-丝氨酸四肽、纤连蛋白、转化生长因子-b2 和肝素都抑制草酸钙的内化。
图 6.3
草酸钙晶体从小管腔转移到乳头表面。上图描绘了肾小管细胞表面、细胞内和与肾小管相邻的间质中的草酸钙晶体(经 Scanning Microscopy Inc. 许可从 25 年起重印。)下图显示了乳头表面的大量晶体以及与肾小管的间隙和间质。条形图 = 25 μm(微米)(经 Scanning Microscopy Inc. 许可重印,自 26 日 起)
在少数可用的患者研究之一中,该小组描述了草酸钙晶体在原发性高草酸尿症个体中的内化。 24
3.2晶体的溶解和胞吞作用
如下一节所述,内化晶体可能发生的事情之一是它们可以溶解。然而,已经提出了另外的命运,即通过上皮细胞层进入肾间质并迁移到肾乳头表面的胞吞作用。使用乙二醇和氯化铵制成高草酸尿的大鼠表现出研究人员所说的“外管性肾炎”,指的是游离晶体或被肾间质细胞包围的晶体(图 6.3 )。 25 在草酸盐攻击后,在间质部位、在稍后的时间点仅在乳头、覆盖乳头表面的上皮下或在肾盂本身中明显观察到晶体。 26 , 27 这些作者认为,覆盖乳头的上皮下的晶体沉积物可以作为草酸钙肾结石发展的病灶。这种沉积物已在人类中描述过。 28 荷兰研究人员提出,巨噬细胞样细胞可能负责晶体从管内部位迁移到乳头状表面。
图 6.4
草酸钙粘附的特异性。上图描绘了大鼠IMCD细胞原代培养物中COM晶体粘附的饱和度。下图显示了与磷灰石同时孵育对 COM 粘附的浓度依赖性抑制(从 39 中的数据重绘,美国生理学会)
4晶体-细胞相互作用的细胞后果
几个小组已经研究了内化晶体会发生什么。在滑膜巨噬细胞/单核细胞或软骨细胞的情况下,晶体的内化导致溶解,细胞钙增加,并且启动了许多细胞信号传导过程。这些包括刺激有丝分裂、激活环氧合酶和磷脂酶C途径、诱导c-fos和c-myc、增加基质金属蛋白酶的分泌和减少组织金属蛋白酶抑制剂。 29 这些影响与已证实的晶体溶解有关。
如前一节所述,还描述了肾小管细胞内晶体的溶解。Lieske、Toback 和同事描述了 BSC-1 细胞中晶体的非常缓慢的溶解。 30 当晶体内化时刺激有丝分裂发生。
草酸钙晶体与几种细胞的相互作用导致这些细胞发生各种变化。细胞膜的溶解、有丝分裂、坏死细胞死亡、炎症变化和细胞凋亡是据报道在细胞暴露于这些晶体后会发生的一些过程。近端小管细胞系暴露于草酸钙晶体会启动 DNA 合成,这些细胞通过 p38 依赖的丝裂原活化蛋白 (MAP) 激酶信号级联反应因血清饥饿而处于静止状态。 31 即使细胞状态没有发生明显的变化,也可能会启动信号级联反应,影响细胞本身的外部过程,但这种变化是否是由于细胞暴露于晶体、草酸盐或两者兼而有之尚不确定。无论如何,这些过程实际上可能是获得性和遗传性高草酸尿症病理生理学的重要组成部分,其特征在于肾间质内的炎症和纤维化变化。 32 , 33 已假定活性氧 (ROS) 可介导其中一些影响。 34
5晶体粘附特异性
许多研究人员已经在细胞培养系统中研究了晶体-细胞相互作用所涉及的结构。在内髓集合管 (IMCD) 细胞的原代培养中,暴露于通常在结石中发现的材料的预制晶体会导致它们的粘附。 35 – 39 该过程展示了一些特异性特征,特别是小于总暴露细胞表面的最大容量和至少某种程度的相互抑制(图 6.5 )。在临床肾结石中发现的所有主要类型的晶体、羟基磷灰石、草酸钙和尿酸都可以附着在各种类型的培养细胞上,表现出相似的动力学参数。
图 6.5
草酸钙对培养的IMCD细胞结构特征的粘附性。上图显示了粘附在原代培养物中聚集细胞上的草酸钙晶体。(经美国生理学会许可从 39 重印。)底部面板描绘了附着在细胞上的晶体,修复了通过刮擦 IMCD 单层制成的伤口。面板 A 和 B 显示静止培养区域缺乏晶体;面板 C 和 D 显示COM粘附在最近生长以覆盖缺陷的细胞上。 面板 E 显示受伤区域和周围未受干扰的培养物的低倍视图(经45 许可转载)
5.1负责特异性的特征
已通过多种方式解决了培养细胞的哪些特征导致晶体粘附的问题。在原代培养中,草酸钙似乎附着在开始组织成索状原管的细胞集合上,从而暴露于通常局限于基底外侧细胞表面的晶体免疫表位(图 6.5 )。因刮擦而“受伤”的培养物会产生一群细胞,其极性在分裂和迁移过程中丧失,以弥补缺陷。这些细胞还表现出增强的晶体附着能力(图 6.5 )。
培养的细胞介导细胞粘附的能力不同。一般来说,细胞单层的组织性越高,晶体粘附的能力似乎就越小。一些培养的细胞系表现出显着的晶体粘附(和吞噬)能力,而有些则没有。在原代 IMCD 细胞培养物中,用 EGTA 裂解细胞间连接与草酸钙粘附的增加有关,随着 EGTA 的去除和钙的提供,其恢复到控制水平。 38
因此,似乎可以安全地得出结论,当泌尿道中的细胞被组织成在组织中观察到的分化良好的单层或多层时,特别是肾小管或远端泌尿道,它们相对抵抗与晶体的相互作用。如前所述,在受伤的膀胱中,裸露的细胞区域是附着有晶体的区域,显然是附着在大量死细胞、细胞碎片和显示纤维蛋白染色的纤维状网状物上。
这类似于在 Randall 斑块上附着的石头所观察到的情况。正如 Evan 和他的同事优雅地说明的那样(图 6.6 ),结石似乎附着在斑块区域,覆盖肾乳头的尿路上皮已被剥蚀。 6 斑块本身(由羟基磷灰石组成)似乎牢固地锚定在乳头的间质内,而不是细胞本身。在结石的外围,似乎有粘附的尿路上皮,因此也出现了直接的晶体细胞附着。然而,结石附着于斑块的主要点似乎是由由尿蛋白和可能的细胞蛋白组成的基质介导的。骨桥蛋白(稍后将详述)似乎连接了结石和乳头间质。
图 6.6
附在兰德尔牌匾上的石头。该图描绘了从患者身上取出的一块石头和下面的组织,显示了上皮剥落的乳头表面钙化斑块的附着部位(转载自 6 ,经 Wiley 许可)
前面提到的研究小组认为,如果不是全部的话,大多数特发性草酸钙结石病起源于 Randall 斑块。然而,一些研究人员指出,如果使用适当的技术足够仔细地寻找,几乎所有个体都可以识别出各种类型的钙化。 28 , 97 , 98 此外,只有大约 40% 的似乎已在肾乳头中形成的通行结石显示出具有 Randall 斑块物质的证据。 99 Ryall 认为,Evan 和同事未能在对照组中发现斑块可能是由于检查的非结石形成者数量较少。 100 因此,虽然 Randall 斑块的存在可能足以形成结石,但可能不是必需的。即使是那些支持兰德尔斑块结石形成起始位点的人也报告了一些情况,其中游离晶体在小管腔中被识别并附着在小管细胞的顶端细胞膜上。这导致研究人员使用体外系统研究晶体与细胞的附着机制。
5.2负责晶体粘附的分子
由于其在肾结石中的优势,草酸钙,特别是草酸钙一水合物 (COM) 的附着,已在结石微晶中进行了最广泛的研究。通过与含磷脂的脂质体孵育来富集膜磷脂磷脂酰丝氨酸可增强草酸钙晶体的附着。 40 此外,这些研究表明,减少膜极性的操作,例如用 EGTA 治疗,正如之前提到的研究中所提到的,也增加了磷脂酰丝氨酸介导的 COM 附着。
糖胺聚糖也与肾小管细胞的晶体附着有关。在增殖亚融合的 Madin-Darby 犬肾 (MDCK) 细胞中或在为覆盖融合培养中诱导的缺陷而进行增殖的细胞中,COM 晶体的结合与透明质酸的表达密切相关,并且可以通过用透明质酸酶处理易感细胞来抑制. 41 在较早的、更间接的研究中,几种糖胺聚糖被证明能强烈抑制晶体附着,这表明所涉及的细胞位点具有这些分子的共同特征。 41 , 42
从培养的大鼠 IMCD 细胞的生物素化顶膜蛋白制剂中,COM 选择性地去除了膜相关蛋白核仁素(图 6.7 )。一条其他无法识别的 200 kDa 条带和低分子量蛋白两性霉素也选择性地附着在 COM 43 上,因此也是候选附着分子。 43 后一种分子以及来自 MDCK 细胞 44 培养基的 200 kDa(千道尔顿)大小的膜糖蛋白的作用,据我所知,尚未得到进一步评估。
图 6.7
COM晶体对特定蛋白质的吸附。图显示了在(泳道 2)与 COM 晶体孵育之前(泳道 1)之后IMCD细胞的溶解顶膜的蛋白质印迹。箭头标记在 220、110(核仁素)和 26 kDa(两性霉素)处的带在上清液(泳道 2)中耗尽并选择性吸附到晶体(泳道 3)(经美国生物化学和分子生物学学会 43 许可转载)
有关核仁素在 COM 附件中的拟议作用的其他数据是可用的。 45 顶端和基底外侧膜上的表面表达随着培养时间的推移而下降,其方式类似于 COM 附着的下降。受刺激繁殖以覆盖由刮擦培养物引起的缺陷的细胞表明增加了顶端表面核仁素表达以及增强的 COM 附着。此外,含有大量酸性氨基酸残基的分子区域在细胞顶膜中的过表达导致COM附着增强,而可溶性酸性片段与膜结合形式竞争,阻止了COM附着的增加.
来自 MDCK 细胞顶膜制剂的 COM 亲和力将膜联蛋白 II 鉴定为潜在的晶体粘附因子。 46 Annexin II 在培养细胞表面通过免疫荧光鉴定,单克隆抗膜联蛋白 II 抗体显着降低了 COM 对细胞的粘附。在没有确定特定膜成分的情况下,整合膜糖蛋白似乎能够基于可溶性阳离子的抑制作用和更重要的神经氨酸酶对附着的抑制作用来介导 COM 附着。 47
另一种尿蛋白骨桥蛋白与体外晶体结合有关。 48 具体来说,与骨桥蛋白一起孵育的 MDCK 细胞显示草酸钙晶体的粘附增加,而与凝血酶(一种骨桥蛋白表达的抑制剂)一起孵育会导致晶体粘附降低。同一组已经证明,用针对骨桥蛋白的反义寡核苷酸转染的 MDCK 表现出较少的草酸钙晶体粘附。 49
与骨桥蛋白在介导晶体粘附中的作用相反,观察到缺乏该分子基因的小鼠在乙二醇喂养后实际上比野生型小鼠更容易受到草酸钙晶体沉积的影响(图 6.8 )。 50 在图中还显示的另一项研究中,缺乏骨桥蛋白基因的小鼠出现了自发的肾乳头间质钙化,这些钙化被确定为羟基磷灰石。 51 此外,与野生型动物的尿液相比,骨桥蛋白缺陷小鼠的尿液在体外抑制 COM 附着于 MDCK 细胞的效果较差。在作者实验室未报道的实验中,外源性骨桥蛋白没有显着粘附到培养的大鼠 IMCD 细胞上,这进一步证明了这种物质在晶体粘附中的作用,至少在体外是这样。最后,骨桥蛋白缺陷小鼠比野生型更容易受到草酸钙晶体沉积和诱导的高草酸尿症的影响这一发现也得到了证实。 51
图 6.8
骨桥蛋白缺陷小鼠对肾内晶体形成的敏感性增强。左两个面板显示在野生型小鼠不显示晶体的条件下,乙二醇喂养后骨桥蛋白缺陷小鼠肾小管中的草酸钙晶体(经 50 许可转载)。右图显示了在骨桥蛋白缺陷小鼠中自发形成的间质羟基磷灰石晶体,上图,以及它们在野生型中的缺失,下图(由 XR Wu 提供)
总结到这一点,很明显,细胞对石头中晶体的吸引力不同。源自远端肾单位段的细胞似乎比其他细胞类型表现出更少的亲和力。亲和力似乎也与细胞损伤或损伤恢复有关。细胞间基质似乎对晶体具有相当大的亲和力。因此,组织的多个成分很可能具有可以介导晶体附着的特征。在下一节中,我们将考虑构成肾组织的大分子的哪些特征或成分可能是造成晶体附着的原因。
5.3晶体细胞粘附的功能组要求
列出的大多数分子的共同特征是它们的酸性,由氨基酸、葡萄糖醛酸、硫酸化糖、磷酸化氨基酸或糖蛋白侧链的末端唾液酸的羧基提供。各种研究人员提出,这些酸性基团通过与 COM 的一些晶体表面的部分阳离子表面电荷相互作用来介导晶体附着。膜联蛋白 II 还具有由肽氧原子、酸性氨基酸和水分子配位形成的钙结合位点。其中一些位点(透明质酸和核仁素)的空间表达似乎与晶体附着相关 45 、 53 ,一些位点的耗尽(唾液酸) 47 已显示减少晶体附着,并且一些据称的酸性附着位点的过度表达与增加的附着相关。 45 虽然仍然不能确定与表面钙原子结合是草酸钙和磷酸钙晶体附着的全部原因,但似乎许多阻断钙结合位点的化合物是草酸钙或其他物质的有效阻断剂。含钙晶体附着。
图 6.9
具有COM晶体特定面的各种功能化AFM尖端的吸引力。图描绘了羧基和脒鎓装饰尖端与 COM 的 (100) 表面之间的强相互作用(经 52 许可转载,版权所有 2005 美国国家科学院)
原子力显微镜 (AFM) 已被用于研究各种官能团与 COM 53 表面之间的相互作用。COM 晶体以最大化特定表面的方式生长,并安装在充满液体的腔室中。通过利用含有特定化学基团的有机硫分子功能化的 AFM 尖端检查各种化学基团的粘附强度。这些尖端与特定的 COM 晶面接触,然后缩回;吸引力被视为将尖端从晶体表面分离所需的力。图 6.9 表明 COO- 和脒基团都强烈粘附在 COM 的 (100) 晶面上,可能是通过与晶体表面上的有序钙原子和草酸盐基团结合。
6个尿酸附着位点
我们小组是第一个描述尿酸附着于培养的肾小管细胞 37 的。尿酸似乎与 COM 竞争一些相同的附着位点,但没有研究可溶性抑制剂。对尿酸附着的唯一系统研究是在 BSC-1 细胞(一种肾小管段起源不确定的非转化细胞系)和 MDCK(一种源自远端肾单位的细胞系)上进行的。 54 尿糖蛋白不抑制附着,但其他尿和合成聚阴离子可以。然而,许多阳离子物质也表现出对附着的抑制作用,显然是当它们覆盖细胞表面时。当晶体与聚阳离子预孵育时,附着增加。具有末端唾液酸的表面糖蛋白在尿酸附着中的作用很难从这些研究中辨别出来,因为结合唾液酸的凝集素没有效果,但神经氨酸酶处理增强了附着。尽管尝试了剂量反应,但未评估抑制剂量与尿酸晶体表面积之间的关系。
之前提到的 200 kDa 蛋白质由 MDCK 细胞分泌到培养基中,当涂在玻璃上时,它会促进 COM、二水合钙、尿酸和透钙磷石的附着,但不会促进磷灰石的附着。 44 这种蛋白质的分子质量与我们报道的选择性粘附于 COM 43 的表面糖蛋白的相似性先前已被评论。最后,在撒丁岛一个尿酸结石发病率高的基因分离人群中,糖胺聚糖的尿排泄似乎减少了, 55 这表明这些物质可能作为结石形成的内源性抑制剂,可能是通过抑制晶体附着。
7个磷灰石和磷灰石附着点
透钙磷石和磷灰石对各种类型的培养肾小管细胞的粘附程度比草酸钙小得多。 39 , 56 然而,对于少数主要表现为磷酸钙肾结石的患者, 57 以及据称在草酸钙肾结石的病理生理学中的作用,附着可能很重要。 6 , 58在之前的工作中,我们报道了磷灰石似乎与 COM 39 共享一些相同的附件站点。其他人提供的证据表明磷灰石与草酸钙粘附在相似的阴离子位点上。 59 一项研究表明透钙磷石附着在培养的人体肠道细胞表面的富含硫的位点上,可能是阴离子硫酸化粘蛋白。 60 项研究证明了阴离子分子抑制磷灰石成核和生长的作用,数不胜数。
8细胞或组织损伤是结石形成的先决条件
如前所述,细胞和组织与晶体的相互作用以包括细胞分裂、炎症、坏死细胞死亡和细胞凋亡在内的反应为特征。如前所述,这些细胞反应中的一些本身可以使细胞接受在肾小管中形成的晶体的粘附,或者可能导致间质钙化。在本节中,我将研究结石形成器中可能存在的条件,这些条件可能会导致细胞功能发生各种改变,从而促进晶体成核或粘附。
8.1高草酸尿
当然,草酸盐是大多数肾结石的主要成分。大多数结石形成者的草酸盐排泄是正常的,但即使在正常个体中,在抗利尿条件下,草酸盐浓度也会上升到相当高的水平,并且草酸盐排泄会随着草酸盐或富含草酸盐前体的膳食而上升。 61 , 62 另一方面,在我们的诊所中,相当比例的结石形成者表现出轻度高草酸尿症,胃肠道疾病或肠切除术可能导致更大程度的高草酸尿症。 63 , 64 此外,遗传性高草酸尿症患者的草酸盐排泄量显着增加。 65 与前面提到的病症相关的高草酸尿已被证明会给结石病的发展以及导致肾功能衰竭的肾脏疾病带来很大程度的风险。 66 一些小组已经检查了草酸盐暴露对细胞的影响。
草酸盐介导的细胞损伤的一些证据来自对人类结石形成者的研究。高草酸结石形成者在血液、尿液或两者中表现出上皮细胞损伤的标志物。 67 – 69 不幸的是,这些发现可能不是结石形成者特有的,也不可能完全排除结石本身或其治疗对损伤标志物排泄的影响。如前所述,高草酸尿症的一些相同作用是通过与草酸钙晶体接触而引起的。 31 需要对经过仔细筛查是否存在结石和其他肾脏或心血管疾病的高草酸非结石形成者进行研究,以解决这个问题。
使用草酸盐本身或生理性草酸盐前体在实验动物中诱导高草酸尿的研究相对较少。大多数动物研究都是使用乙二醇诱导高草酸尿症,这种操作可能会诱导细胞对其他有毒代谢物的改变。例如,草酸钠的急性腹腔给药导致肾乳头尖端的病理变化;然而,这种操作也产生了草酸钙晶体沉积,因此无法确定单独草酸离子的作用是什么。 70
细胞培养物在体外暴露于草酸盐至少就草酸盐本身的毒性而言是无可争议的。许多肾小管细胞类型的暴露会激活磷脂酶 A2,导致花生四烯酸和溶血磷脂酰胆碱的释放以及线粒体损伤。 71 这种效应以及其他来源,例如通过 NADPH 氧化酶的激活,可能有助于观察到响应草酸盐的活性氧 (ROS)。 72 这些研
体外草酸盐暴露也描述了与细胞凋亡相关的信号级联反应。其中之一是磷脂酰丝氨酸从细胞膜内膜到外膜的重新分布。 73 , 74 如本章前面所述,磷脂酰丝氨酸可作为 COM 40 的附着位点。凋亡细胞也可能表现出增加的 COM 附着,至少在 体外 4、75 脚注1 ; 然而,在草酸盐排泄轻度增加的实验动物中,工业毒素诱导细胞凋亡时,没有观察到晶体保留增加。 76 这些实验并未排除细胞凋亡率增加的更长期影响。虽然,为了使这在体内很重要,据推测,凋亡细胞的产生速度必须超过可用机制容易清除的速度。草酸盐是否可以诱导巨噬细胞清除凋亡细胞的限制尚未得到检验。
许多肾细胞系表现出增强的 p38 MAP 激酶活性,从而增加了 DNA 合成和细胞增殖。 77 , 78 使用较高浓度的草酸盐,通常超过预期的体内暴露量,观察到细胞损伤和培养单层剥落。 79 如前所述,通过刮擦培养物诱导分裂的细胞表现出增强的晶体附着,因此如果发生成核,暴露于浓度太低而不会引起明显损伤的草酸盐可能仍会调节细胞的晶体附着。然而,应该注意的是,培养的 IMCD 细胞似乎比其他细胞类型更能抵抗草酸盐的影响。 80 考虑到肠道高草酸尿症和遗传性高草酸尿症中任何一种类型的尿中草酸盐排泄量表明,IMCD 中的小管细胞可以看到观察到的浓度类型,以诱导增殖或毒性作用。他们是否看到草酸盐浓度足以在通常的草酸钙结石形成剂中引起这些影响 - 即使其中很大一部分表现出轻度高草酸尿症 - 尚未确定。肠道旁路引起的草酸盐暴露似乎不会引起磷灰石间质钙化。 1
8.2高钙尿症
虽然很明显急性高钙尿症会引起肾功能的可逆变化,但对肾小管结构和功能的更慢性影响尚不清楚。考虑到 Dent 病的情况,可能会收集到关于这个问题的最有用的数据,其中低分子量酶尿症和高钙尿症相关。 81 然而,前者似乎是由于干扰近端肾单位内体功能所致;至少在 CCL5 缺陷小鼠模型中,高钙尿症似乎是肠道钙吸收增强的结果。 82 虽然高钙尿症可能是晶体形成和沉积的原因,并伴随着损害,但似乎高钙尿症本身与会促进尿路结石病的组织变化无关。 83
8.3高磷尿症
患有结石病的患者通常表现出高水平的尿磷酸盐排泄,这可能是由于饮食摄入过多或作为吸收性高钙尿症综合征的一个组成部分的肾磷酸盐泄漏。 84 磷酸尿导致的肾损伤尚未得到直接研究,因为这种情况在临床情况下主要与其他异常有关,例如范可尼综合征。 85 已经描述了因磷酸钠协同转运蛋白突变而导致磷酸尿症和肾结石的患者。 86 这些人没有明显的肾损害证据。PHEX基因突变的个体表现出 x 连锁低磷性佝偻病的患者,除非发生肾钙质沉着症,否则似乎也没有肾结构或功能异常。 87 据报道,在大鼠中,含有 1% 钙和 2% 元素磷的饮食至少会在雌性中诱导皮质髓质磷酸钙沉积。 88 , 89 然而,一旦发生晶体沉积,就不可能说是磷酸尿还是晶体沉积导致了肾损伤,例如在患有肾小管酸中毒的个体中所描述的。 90 然而,在血管组织中,磷酸盐暴露会导致钙化,其中一些让人想起与基质囊泡相关的描述。 91 , 92 磷酸盐暴露是否会诱导由肾脏内髓质中的小管细胞组成性产生的基质囊泡内部或周围的钙化,或者作为一种可能的微妙损伤形式,磷酸盐是否会增加基质囊泡的产生,这将是一个富有成果的领域。未来的学习。
8.4高尿酸尿
当然,尿酸结晶本身就具有很强的炎症性。因此,预计此类晶体的沉积会诱发肾损伤。然而,即使是轻微的高尿酸血症,似乎也会诱导由 ROS 介导的内皮损伤,显然是通过降低一氧化氮的可用性。 93 肾小管是否以这种方式易感尚不清楚,但众所周知,高尿酸尿是草酸钙结石病的危险因素。 94 这通常归因于几个因素,包括尿酸或尿酸单钠促进异质成核,阻断尿液大分子对草酸钙晶体形成的某些抑制作用,或降低草酸钙的亚稳态极限。尿酸。 95 然而,肾小管细胞暴露于尿酸晶体或可溶性尿酸似乎也增强了 COM 的附着。 96
9结论
晶体或结石的其他固体成分与细胞或肾组织相互作用的作用是复杂的。在肾脏或泌尿道中观察到结石的部位,通常似乎对这种材料的固定有抵抗力,尽管它们可能会粘附并更容易被肾脏或泌尿道外的细胞吸收。即使在泌尿道内,晶体或固体也可能粘附并被近端小管细胞吸收,而不是被集合管或尿路上皮中的那些细胞吸收。晶体材料也可以在间隙空间内形成。无论是通过管状流体的沉积和附着还是细胞外的形成,某种形式的细胞或组织损伤可能是先决条件。虽然晶体或固体本身可能会引起细胞变化,其他情况,如高草酸尿症可能会引起促进晶体粘附的变化。似乎附着是由出现在细胞表面上的特定分子介导的,或者当细胞损伤或组织损伤发生时,它们是细胞外基质的成分。这些分子具有允许与晶体的分子成分相互作用的官能团。其中最好的描述是羧基与 COM 的 (100) 面之间的相互作用。
图 6.10 说明了晶体或固体与肾组织的相互作用,因为本章的作者设想了它在肾结石病理生理学中的作用。示意图显示了可能在小管内形成的 COM 晶体的示意图,这些小管附着在完整细胞上(在功能或损伤不存在或存在细微改变的情况下,经历细胞凋亡的细胞,或小管区域已被剥落细胞。这些晶体可能是通过在含有过饱和结石成分的管状流体中成核形成的,或者正如 Khan 和同事所提出的,在小管内的细胞碎片上形成。据推测,其他类型的晶体,如尿酸或胱氨酸,也可以形成以这种方式固定在小管壁上。附着在小管细胞上的晶体可以通过其他晶体的聚集而生长,这些晶体漂浮在它们的表面或通过其表面的二次成核,最终通过侵蚀或延伸到乳头尖端或表面形成临床结石。这些晶体也可以被细胞吞噬,导致它们向间质移动。在那里,它们可能在单核细胞内被主动运输到乳头表面,在那里它们侵蚀并形成病灶,形成临床结石。或者,羟基磷灰石形式的钙化可能发生在 Henle 环的基底膜中,可能是通过凋亡小体或受损细胞脱落的基质囊泡的钙化。正如 Evan 及其同事所提出的,这些构成了临床观察到的 Randall 斑块的基础。斑块通过乳头表面的侵蚀。
图 6.10
草酸钙和羟基磷灰石与肾组织在肾结石病理生理学中的相互作用。见文字说明。兰德尔斑块中钙化囊泡的显微照片由 A. Evan 提供(附在肾乳头上的石头图像由 Neil Mandel 博士提供)
不感兴趣
看过了
取消

人点赞

人收藏

打赏
不感兴趣
看过了
取消






您已认证成功,可享专属会员优惠,买1年送3个月!
开通会员,资料、课程、直播、报告等海量内容免费看!

打赏金额
认可我就打赏我~
1元 5元 10元 20元 50元 其它
打赏作者
认可我就打赏我~
扫描二维码
立即打赏给Ta吧!
温馨提示:仅支持微信支付!
已收到您的咨询诉求 我们会尽快联系您
