针对特定的医疗器械产品,明确在矩阵的高严重度区域或在高概率区域,或簇在临界线附近的风险的允许数量。
听到“风险管理”四个字,你是不是开始头皮发麻?
随着ISO14971:2019的实施,各国对于风险管理的要求也越发严格。看着密密麻麻枯燥乏味的标准原文,你是不是觉得脑袋疼?
今天,我们来共同解读一下令人头疼的风险管理。
一、风险管理有哪些标准?
目前,国内外普遍使用的风险管理标准是ISO14971以及它的应用指南ISO/TR24971,借助下图我们来简单了解一下它的历史:
截至目前为止,国内关于风险管理的标准转化情况如下表所示:
二、ISO 14971:2019修订了哪些内容?
ISO 14971:2019对比2007版标准,主要修订点有:
① 更新术语定义,新增受益、可合理预见的误使用、最新技术水平的定义;
② 扩大了风险管理的适用范围,如数据和系统安全;
③ 更加关注医疗器械使用中的预期受益;
④ 风险管理过程做了调整;
⑤ 风险管理计划规定剩余风险评价方法和可接受性准则;
⑥ 危险和危险情况的识别中,危险由4大类改为3大类,并且增加数据和传输等相关危险;
⑦ 风险评价规定如果风险可以接受,应视为剩余风险;
⑧ 受益-风险分析中的要求做了调整;
⑨ 综合剩余风险评价中修改了剩余风险公示的时机;
⑩ 风险管理报告改为风险管理评审;
⑪ 生产和生产后信息改为活动;
⑫ 部分附录转移至ISO/TR 24971等。
三、如何开始风险管理?
在开始整个风险管理之前,我们需要做一些准备工作。
1.制定风险管理计划
标准的要求是这样的☟
本次修订最大的改变就是:制造商需要在计划中制定评价综合剩余风险的方法和可接受性准则。这对大家来说是一项新的挑战,而现阶段大家都处在摸着石头过河的阶段。
2.成立风险管理小组
风险管理小组的人员应该具备相关资质,此类人员应了解“医疗器械的构造、工作、生产、使用以及如何应用风险管理过程”,一般而言,需要包括以下职能:研发、品质、工艺、市场(产品经理)、临床、注册、项目管理、设计控制。
风险管理不是某一个人或某一个部门能够单独完成的,需要整个团队,甚至整个公司配合完成。
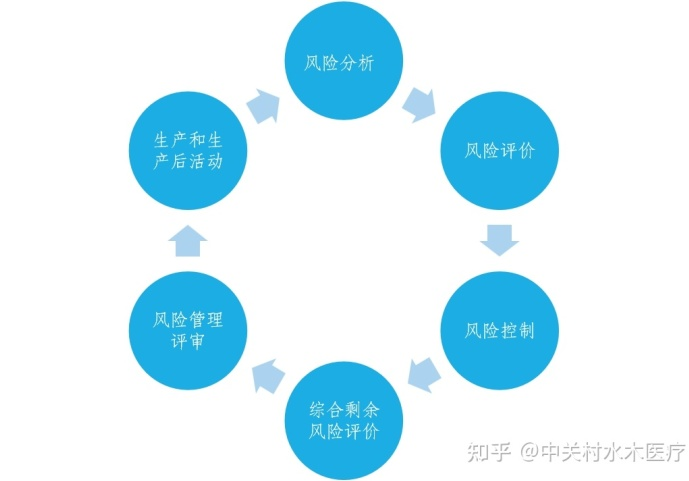
四、风险管理过程
风险管理过程贯穿产品整个生命周期,环环相扣,相辅相成,形成一个闭环。
整个风险管理过程包括:
风险分析(Risk analysis)、风险评价(Risk evaluation)、风险控制(Risk control)、综合剩余风险评价(Evaluation of overall residual risk)、风险管理评审(Risk management review)、生产和生产后活动(Production and post-production activities)。
下面我们逐个分析。
1.风险分析
怎么进行风险分析呢?ISO14971:2019要求,制造商应按照以下内容进行风险分析:
预期用途和可合理预见的误使用(Intended use and reasonably foreseeable misuse);
与安全有关的特征的识别(Identification of characteristics related to safety);
危险和危险情况的识别(Identification of hazards and hazardous situations);
风险估计(Risk estimation)。
1.1预期用途和可合理预见的误使用
什么叫预期用途?大部分人都会认为不就是适应症吗?我们先来看看标准中的定义:
按照制造商提供的规范、说明书和信息,对产品、过程或服务的预期使用。
本次更新还特意增加了注解,见下图:
除了适应症,还需要考虑以下方面:
l 患者群体,如年龄组、性别或疾病状态;
l 与之交互的身体部位或组织类型,如手臂或腿;
l 用户特征,如患者、非业内人士、医护人员;
l 使用环境,如家庭,医院,正在监护病房;
l 工作原理:如X射线成像。
以上的所有要素才构成了“完整”的预期用途。这些是进行风险分析不能遗漏的重要部分。
什么叫可合理预见的误使用呢?标准中的定义是:
由容易预测的人的行为所引起的,未按制造商预期的方式对产品或系统的使用。
容易预测的人包括全部类型的用户行为,例如非专业的和专业的用户,这种误使用可能是有意或无意的。
比如,一次性使用的产品,很有可能会导致使用者试图再次使用,因此“请勿二次使用的警告和可能的伤害”应包含在随附文件中。有些器械设计只要用了就无法再次使用也是为了降低这种误使用的风险。
1.2与安全有关的特征的识别
能用作识别影响安全的医疗器械特性的问题清单已由ISO 14971:2007附录C移动至ISO/TR 24971 :2020 附录A, 并且由由34个大问题(C.29包含8个小问题)改为 37个大问题(A.2.31包含9个小问题)。
问题清单能够帮助识别可能影响安全的医疗器械的所有特征。建议风险管理小组成员不仅从自己的角度,也应该从相关的其他人员角度考虑每一个问题。
问题清单如下(翻译来自YY/T 1437-20XX征求意见稿):
与上一版标准相比,问题中增加或细化了与数据和数据安全性相关的内容如问题18、20、21,新增了31.7、36、37这些问题。
制造商应基于预期用途,可合理预见的误使用以及正常和故障情况下的与安全有关的特征,识别已知的和可预见的医疗器械相关的危险并且记入危害分析报告。
1.3危险和危险情况的识别
ISO14971:2019 附录C-危险和危险情况的识别中,危险由4大类改为3大类,并且增加数据和传输等相关危险,详见下图:
制造商可从产品技术或性能要求、制造过程、运输和贮存、环境因素、清洁、消毒和灭菌、处置和报废、配方、可用性、功能性、信息安全等方面进行识别,该附录已经详述了如何识别危险情况、可预见的事件序列,并且举了很多例子,此处不再一一赘述。
2.风险评价
前面两个步骤已经将风险尽可能全面的识别出来了,接下来就需要对这些风险进行评价。对于每个已识别的危险情况,应使用风险管理计划中定义的风险可接受性准则评价估计的风险,并确定此风险是否可接受。
如果风险可以接受,则风险控制活动要求不适用于危险情况,此估计的风险应视为剩余风险。如果风险不可接受,应执行风险控制活动。这一点也是本次主要修改点之一。
3.风险控制
ISO 14971:2019条款7将风险控制分为以下步骤:
这些步骤,细讲篇幅很长,会让读者陷入读标准原文的错觉,我们只讨论修订点。本次修改的主要有风险方案分析和受益-风险分析。ISO 14971:2019 7.1中建议按照以下优先顺序,使用一种或多种风险控制方案:
a)固有安全的设计和制造;
b)医疗器械本身或制造过程中的防护措施;
c)安全信息和适当时的用户培训。
ISO/TR 24971:2020 7.1.1 针对上述方案中提供了很多解释和例子,此处由于篇幅原因也不再赘述。
而对于受益-风险分析,如果使用风险管理计划中建立的准则(企业自己制定),判定某个剩余风险是不可接受的,而进一步的风险控制又不可行,制造商可以收集和评审资料和文献,以便确定预期用途的受益是否超过该剩余风险。
如果受益超过该剩余风险,则前进到由风险控制措施引起的风险。反之,考虑修改医疗器械或预期用途。否则,该风险是不可接受的。
受益-风险如何比较,ISO/TR 24971:2020 7.3-7.4 提供了一些思路和方法,感兴趣的伙伴可以看原文深入理解,此处只一图带过。
4.综合剩余风险评价
本次修改最值得讨论的点无异于综合剩余风险评价,这也是企业最头疼的点。到底什么叫综合剩余风险,到底如何进行评价?14971标准原文如下:
很可惜,没有明确告诉我们怎么做,由制造商自己制定接受准则,自己进行评价。
但好在ISO/TR 24971:2020 8.3提供了一些可能的方法,我们可以参考、思考,形成企业内部的评价方法。这些方法汇总如下:
① 权衡与医疗器械预期用途相关的受益和综合剩余风险;
② 剩余风险可视化;
③ 可以将所考虑医疗器械与上市类似医疗器械进行比较;
④ 可以请专家来协助对综合剩余风险的评价,该评价与使用所考虑医疗器械的预期受益有关。
这里重点讨论剩余风险可视化。每个单个剩余风险可以在风险图或风险矩阵中表示,图示化风险的分布。
如果许多风险在矩阵的高严重度区域或者在高概率区域,或者风险簇在临界线附近,则这种分布可能表明综合剩余风险可能不可接受,即使每个单个风险已经判定为可接受。
举个例子,我们可以先将严重度和发生概率划分等级(可用数字表示分级),做成矩阵图。再根据企业内部中的接受标准,涂上颜色,如下图所示。
针对特定的医疗器械产品,明确在矩阵的高严重度区域或在高概率区域,或簇在临界线附近的风险的允许数量。至于允许数量如何界定,则由企业自己制定。
综合剩余风险的评价难度高,需要权衡的多,可以看出一家企业的“软实力”,注重风险管理的企业,往往能在产品上市前规避掉很多风险,这何尝不是另一种降低成本的方法呢?
5.风险管理评审
在医疗器械商业销售发布前,制造商应对风险管理计划的实施情况进行评审。评审应至少确保:
✦ 风险管理计划已被适当地实施;
✦ 综合剩余风险是可接受的;
✦ 已有适当方法收集和评审生产和生产后阶段的信息。
从这几点不难看出,风险管理是一个动态的过程,不断更新迭代,不断重复分析-评价-控制-优化,只要产品仍在市场,这种循环就永不停止。
6.生产和生产后活动
这部分内容也是重点修订的地方。生产和生产后”信息“改为“活动”,并细化为总则、信息收集、信息评审、措施四大部分。详见下图。
7.总结
看到这里,你对风险管理有个初步的认识了吗?没有也没关系,这是个需要终身学习的主题。用风险管理的思维,不仅能让工作少碰壁,在生活中也同样可以让你如鱼得水。
最后,放一个完整的风险管理示意图作为结尾吧,愿我们的工作和生活总能“化险为夷”“绝处逢生”。
不感兴趣
看过了
取消

人点赞

人收藏

打赏
不感兴趣
看过了
取消






您已认证成功,可享专属会员优惠,买1年送3个月!
开通会员,资料、课程、直播、报告等海量内容免费看!

打赏金额
认可我就打赏我~
1元 5元 10元 20元 50元 其它
打赏作者
认可我就打赏我~
扫描二维码
立即打赏给Ta吧!
温馨提示:仅支持微信支付!
已收到您的咨询诉求 我们会尽快联系您
