本研究为了解携带KRAS G12C和KRAS G12D突变的NSCLC患者的临床特征及治疗结局提供了来自真实世界的见解
KRAS G12D和G12C突变具有不同的生物学特性,这些特性会影响治疗反应。本研究旨在探究携带这些突变的转移性非小细胞肺癌(NSCLC)患者在真实世界中的人口统计学特征、临床特征以及一线治疗的结局。这项回顾性、多机构的观察性研究使用了来自AURORA数据库的数据。研究纳入了在2010年1月1日至2024年4月30日期间被诊断为携带KRAS G12D或G12C突变的转移性NSCLC、年龄在18岁及以上的患者。采用描述性统计方法对患者特征进行比较,并使用 Cox 比例风险回归模型评估至事件发生时间相关的结局。
本研究共纳入了298名患者(其中216名携带KRAS G12C突变,82名携带KRAS G12D突变)。KRAS G12D突变的患者组中从不吸烟者的比例更高(15% vs. 1%,P < 0.01),PD-L1表达<1%的患者比例也更高(36% vs. 21%,P = 0.06)。在不同突变组之间,总生存期(OS)(HR 1.09,95%CI 0.80 - 1.48,P = 0.60)和真实世界无进展生存期(rwPFS)(HR 1.21,95%CI 0.92 - 1.59,P = 0.18)均未观察到显著差异。在携带KRAS G12C突变的患者中,与单纯化疗相比,单药免疫治疗(HR 0.61,95%CI 0.39 - 0.97,P = 0.04)和化疗联合免疫治疗(HR 0.59,95%CI 0.37 - 0.94,P = 0.03)可改善OS。对于携带KRAS G12D突变的患者,与单纯化疗相比,免疫治疗(HR 0.74,95%CI 0.29 - 1.89,P = 0.53)和化疗联合免疫治疗(HR 0.73,95%CI 0.34 - 1.57,P = 0.42)均未改善OS。
KRAS G12C和G12D突变显示出不同的临床特征和治疗反应,携带KRAS G12D突变的患者接受免疫治疗的结局更差。需要进行前瞻性研究来验证这些发现。
在携带KRAS G12C突变与KRAS G12D突变的NSCLC患者中,观察到了临床人口统计学方面的差异;KRAS G12D突变患者中从不吸烟者和PD-L1阴性的病例更多;
接受免疫治疗的KRAS G12D突变患者生存结局更差;
在二线治疗中,KRAS G12C突变和KRAS G12D突变的NSCLC患者所使用的药物存在差异;
TP53和STK11是检测到的最常见的共突变基因。
研究背景
KRAS是NSCLC中最常发生突变的癌基因之一,大约30%的病例中会出现该基因突变。KRAS突变具有异质性,在其致癌潜能、治疗意义以及预后重要性方面表现出差异。在这些突变中,KRAS G12C和KRAS G12D变异尤其受到关注,据估计,在NSCLC中,它们的发生率分别为15%和4%。尽管已经研发并获批了几种针对KRAS G12C的靶向治疗药物,包括索托雷塞(sotorasib)和阿达格拉西布(adagrasib),但针对KRAS G12D的药物仍处于临床研发的早期阶段。尽管在靶向治疗方面取得了进展,但对于KRAS G12C和KRAS G12D突变的转移性NSCLC,标准的一线治疗方案仍然是化疗和/或免疫治疗的联合。
描述携带这些突变患者的人口统计学和临床特征的真实世界数据有限。此外,与一线全身治疗相关的治疗结局仍不明确,尤其是对于KRAS G12D突变的情况。新兴研究表明,在治疗反应、生存结局以及与临床病理因素(如吸烟状态和PD-L1表达)的关联方面,KRAS G12D和KRAS G12C突变之间可能存在差异。最近的一项荟萃分析报告称,与KRAS G12D突变相比,KRAS G12C突变采用基于免疫治疗的方案治疗时结局更好。然而,其他真实世界研究并未报告在疗效结局方面存在任何差异。此外,KRAS G12C突变与较高的PD-L1表达以及与吸烟存在密切关联,而KRAS G12D突变在非吸烟者中更常被观察到,并且与较低的PD-L1表达相关。KRAS G12D和KRAS G12C突变表现出独特的生物学特征,例如在细胞因子分泌、代谢适应和免疫检查点调节方面的差异,这些特征塑造了免疫微环境并影响治疗反应。例如,KRAS G12D突变与促炎细胞因子增加和免疫抑制信号传导相关,而KRAS G12C突变可以上调PD-L1并促进巨噬细胞介导的免疫逃逸,这两者都会影响靶向治疗和免疫治疗的疗效。关于治疗效果的报告稀缺且不一致,以及这些突变之间的生物学差异,都突显了进一步研究的必要性。
随着靶向KRAS突变的治疗策略不断发展,了解携带KRAS G12D和KRAS G12C突变患者的疾病自然史以及治疗结局至关重要。这些深入的认识将指导个性化治疗方案的选择,确定最有可能从特定治疗中获益的患者亚组,并完善纳入标准和终点指标,以优化未来临床试验的设计。因此,本研究旨在通过描述携带KRAS G12D突变的NSCLC患者的人口统计学和临床特征,并评估他们的一线治疗结局来填补这一空白。此外,研究者将这些研究结果与在携带KRAS G12C突变患者中观察到的结果进行直接比较,对这些具有临床意义的患者亚组进行全面分析。
研究结果
人口统计学特征:
本研究纳入了298名患者,其中216名携带KRAS G12C突变,82名携带KRAS G12D突变。中位随访时间为14.2个月(四分位距[IQR]:5.3-30.8个月)。在研究队列中,观察到了203例死亡事件和249例疾病进展事件。表1总结了研究人群的人口统计学特征。转移性疾病确诊时的中位年龄为67岁(IQR:63-74岁),KRAS G12C突变患者和KRAS G12D突变患者之间无显著差异(P值 = 0.14)。大多数患者的ECOG体能状态评分为0-1分,为既往吸烟者,并且在2018年-2024年期间接受治疗。与携带KRAS G12C突变的患者相比,KRAS G12D突变的患者中从不吸烟者的比例更高(15% vs 1%,P值 < 0.01)。携带KRAS G12D突变的患者中PD-L1阴性的比例更高(36% vs 21%,P值 = 0.06),而携带KRAS G12C突变的患者队列中PD-L1高表达的比例更高(47% vs 35%,P值 = 0.06)。KRAS G12D突变患者和KRAS G12C突变患者之间在其他人口统计学方面没有显著差异,这表明该队列在其他方面是平衡的。

表1
2018 - 2024年期间的治疗模式:
在此期间共治疗了220名患者,其中156名(71%)存在KRAS G12C突变,64名(29%)存在KRAS G12D突变。表2总结了2018年至2024年期间接受治疗患者的治疗模式。大多数患者(81%)接受了一线系统性治疗,其中包括单一免疫疗法(27%)或化疗免疫疗法(38%),12%的患者仅接受了化疗。在接受单一免疫疗法的患者中,93%(n = 53)的患者PD - L1状态≥50。6%的患者采用了以治愈为目的的寡转移治疗方法,即采用确定性放化疗或手术与立体定向放射治疗(SBRT)相结合的方式。重要的是,有28名(13%)患者被认为不适合进行系统性治疗,因此接受了最佳支持治疗。携带KRAS G12D(与KRAS G12C相比)的患者在一线治疗方面存在显著的统计学差异,接受最佳支持治疗(25% vs 7.7%,p值<0.01)和化疗免疫疗法(44% vs 35%,p值<0.01)的比例更高。

表2
在173名病情进展的患者中,只有52名(30%)患者接受了后续的二线系统性治疗。根据KRAS G12C或KRAS G12D突变状态,接受二线系统性治疗的患者之间没有统计学差异(分别为33% vs 23%,p值=0.22)。最常见的二线治疗方法是化疗(40%),其次是单一免疫疗法(21%)、索托雷塞(19%)、临床试验(12%)和化疗免疫疗法(8%)。与KRAS G12C患者相比,KRAS G12D患者接受化疗的比例有所增加(75% vs 30%,p值=0.06),但这并无统计学意义。
疗效结局:
整个队列的中位OS和rwPFS分别为17.3个月(95%CI 13.8-22.1个月)和7.82个月(95%CI 6.4-9.7个月)。聚焦于仅接受一线系统治疗的患者(即未接受确定性放疗、手术或最佳支持治疗的患者),其中位OS和rwPFS分别为21.4个月(95%CI 17.2-26.8个月)和10.2个月(95%CI 8.3-11.9个月)。
对整个研究人群进行单因素分析时,携带KRAS G12D突变的患者与携带KRAS G12C突变的患者相比,在OS(HR 1.09,95%CI:0.80至1.48,P值 = 0.60)或rwPFS(HR 1.21,95%CI:0.92-1.59,P值 = 0.18)方面没有差异(图1)。当仅纳入接受一线系统治疗的患者时,这种关系并未改变。携带KRAS G12C突变患者的12个月生存率估计为62%,携带KRAS G12D突变患者的为53%(HR 1.07,95%CI:0.73-1.57;P = 0.73)。携带KRAS G12C突变患者的24个月生存率为43%,携带KRAS G12D突变患者的为39%(HR 1.38,95%CI:0.98-1.94;P = 0.06)。就rwPFS而言,携带KRAS G12C突变患者的12个月rwPFS估计为38%,携带KRAS G12D突变患者的为31%(HR 1.09,95%CI:0.80-1.50,P值 = 0.58)。携带KRAS G12C突变患者的24个月rwPFS为23%,携带KRAS G12D突变患者的为16%(HR 1.31,95%CI:0.94-1.82,P值 = 0.11)。

图1
在携带KRAS G12C突变的患者队列中,与单纯化疗相比,免疫单药治疗(HR 0.33,95%CI:0.21-0.51,P值 < 0.01)和化疗联合免疫治疗(HR 0.42,95%CI:0.28-0.63,P值 < 0.01)均与rwPFS的改善相关(图2)。与单纯化疗相比,免疫单药治疗(HR 0.61,95%CI:0.39-0.97,P = 0.04)和化疗联合免疫治疗(HR 0.59,95%CI:0.37-0.94,P = 0.03)也与OS的改善相关(表3和图2)。在多因素分析中,接受免疫单药治疗和化疗联合免疫治疗的患者rwPFS均有所改善,而只有接受化疗联合免疫治疗的患者OS有所改善(表3)。

图2

表3
在携带KRAS G12D突变的亚组患者中,与单纯化疗相比,化疗联合免疫治疗(HR为0.51,95%CI:0.26-0.98,P = 0.04)与rwPFS的改善相关(图3)。然而,与单纯化疗相比,免疫单药治疗在rwPFS方面并未显示出统计学意义上的改善(HR为0.66,95%CI:0.31-1.40,P = 0.28)(图3)。与单纯化疗相比,免疫单药治疗(HR 0.74,95%CI:0.29-1.89,P = 0.53)和化疗联合免疫治疗(HR 0.73,95%CI:0.34-1.57,P = 0.42)也与OS的改善无关(表3和图3)。在多因素分析中,与单纯化疗相比,无论是免疫单药治疗还是化疗联合免疫治疗,在rwPFS或OS方面均未显示出统计学意义上的改善(表3)。

图3
共突变的描述性研究结果:
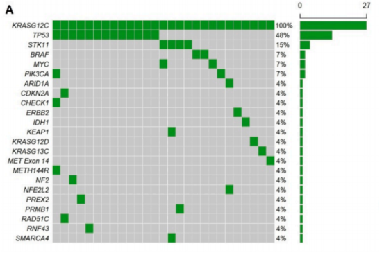
在本研究人群中,并未对进行了扩展分子检测的患者作出明确界定,但在41名患者中发现了共突变情况。图4总结了这些患者中共突变的分布情况。TP53突变是最常被检测到的共突变,存在于19名患者中,其次是STK11突变,在8名患者中被观察到。其他检测到的共突变包括NKX2-1和MYC突变,各存在于3名患者中,以及PIK3CA突变,也存在于3名患者中。BRAF和KEAP1突变各在2名患者中被发现,而其他一些突变,包括CDKN2A、RAD51C、CHECK1、METH144R、ERBB2、IDH1、KRAS G12C、KRAS G13C、MDM2、MET外显子14、ARID1A、FBXW7、NFE2L2、PREX2、SMARCA4、NF2、RNF43、BRCA2和CDK4突变,则分别在单名患者中被观察到。在KRAS G12C突变患者和KRAS G12D突变患者中,TP53突变患者的比例在数值上相近。然而,STK11突变在KRAS G12D突变患者队列中更为常见。存在共突变的患者的中位rwPFS和OS分别为8.5个月(95%CI:7.3-12.0个月)和31.3个月(95%CI:10.3-未达到)。

图4
讨 论
本研究描述了澳大利亚九家机构中携带KRAS G12D或KRAS G12C突变的转移性NSCLC患者在真实世界中的治疗模式和治疗结局。携带KRAS G12D突变的患者更有可能是从不吸烟者,这与新出现的证据相符,该证据表明与KRAS G12C突变相比,KRAS G12D突变可能通过不同的致癌途径产生,而KRAS G12C突变与吸烟相关的致癌作用密切相关。此外,本研究显示出一种趋势,即KRAS G12C突变患者中PD-L1表达≥50%的比例更高,而KRAS G12D突变患者中PD-L1表达阴性或较低的比例更高。尽管这些差异未达到统计学显著性,但它们可能反映了不同的免疫微环境特征,值得在未来的研究中进一步探讨。值得注意的是,当接受单药免疫治疗或化疗联合免疫治疗时,携带G12C突变的患者更有可能获得更好的生存结局,而携带G12D突变的患者获益较少,这很可能反映了这些肿瘤免疫原性的改变。
本研究还报告了与KRAS G12C突变的患者相比,KRAS G12D突变的患者在治疗模式上存在明显差异。携带KRAS G12D突变的患者中,接受最佳支持治疗的比例更高。然而,接受积极治疗的患者较少的原因尚不清楚,因为在这些组别的患者中,未观察到年龄或体能状态方面的差异。此外,与携带KRAS G12C突变的患者相比,更多携带KRAS G12D突变的患者接受了化疗联合免疫治疗,这可能是因为KRAS G12C突变亚组中PD-L1高表达状态的患者比例更高。
在二线治疗所使用的药物方面存在差异,携带KRAS G12D突变的患者主要仅接受化疗,而携带KRAS G12C突变的患者更常接受化疗或索托雷塞治疗。目前,针对KRAS G12D突变的靶向治疗药物仍处于研发的早期阶段,因此,这一患者群体在临床试验之外的治疗选择相对较少。另一方面,根据KRYSTAL-12和Codebreak-200研究的结果,阿达格拉西布和索托雷塞已被批准用于既往接受过治疗的携带KRAS G12C突变的患者,从而增加了治疗选择。然而,在本研究队列中,索托雷塞的总体使用情况有限,只有25%的患者接受了这种药物治疗,而其他研究中报告的使用比例高达80%。这在很大程度上是因为索托雷塞未被纳入澳大利亚药品福利计划(PBS),患者需要通过同情用药途径或自费获取该药物。重要的是,在本研究队列中,只有三分之一的患者接受了后续的二线治疗,这突显了迫切需要改进治疗策略。
虽然本研究并未发现携带KRAS G12D突变和KRAS G12C突变的患者在rwPFS和OS方面存在显著差异,但治疗效果却有所不同。在携带KRAS G12C突变的患者队列中,与单纯化疗相比,免疫单药治疗和化疗联合免疫治疗均与wPFS和OS的显著改善相关。相比之下,在携带KRAS G12D突变的亚组患者中,无论是免疫治疗还是化疗联合免疫治疗,均未显示出OS的显著改善。然而,样本量较小可能限制了检测出差异的效能。本研究结果与当前的文献一致,包括最近的一项荟萃分析,该分析报告称,与其他KRAS突变相比,KRAS G12D突变对OS有负面影响。然而,先前的真实世界研究结果不一;一项研究发现,KRAS G12D突变和G12C突变患者在生存结局方面没有差异,不过与我们这项进行了疗效分析(比较化疗联合免疫治疗、免疫单药治疗及化疗的疗效)的研究不同,该研究并未比较化疗联合免疫治疗与免疫单药治疗或化疗的疗效。另一项研究报告称,携带KRAS G12D突变的患者无PFS和OS更佳,不过该研究关注的是一个较小的拉丁美洲患者队列,这可能是导致研究结果不一致的原因。本研究结果表明,由KRAS G12D驱动的NSCLC可能代表了一种独特的临床和分子表型,对免疫单药治疗的反应较差,这一点需要在未来的前瞻性研究中进一步探索。
KRAS G12D和KRAS G12C突变表现出不同的生物学行为,这推动了针对特定突变的治疗方法的发展。G12D突变会导致内在的GTP结合量增加以及KRAS的持续激活,使其对外部刺激的依赖性降低,而G12C突变则含有一个具有反应活性的硫醇基团,为共价抑制剂提供了一个独特的可成药位点。因此,针对KRAS G12C突变的治疗药物,如索托雷塞和阿达格拉西布,已经获得了监管部门的批准,而针对KRAS G12D突变的药物,包括选择性非共价抑制剂MRTX1133,仍处于临床研究阶段。其他前瞻性研究包括将其与SHP2抑制剂联合使用以阻断上游信号传导,以及使用针对下游通路的MEK或ERK抑制剂。泛KRAS药物也处于早期研发阶段,为治疗KRAS突变的癌症提供了潜在的新途径。
本研究还评估了队列中部分患者中共突变的发生情况。共突变在KRAS突变NSCLC的分子生物学特征、临床进程以及治疗反应方面起着关键作用。与先前的研究一致,在本研究的队列中,TP53和STK11是最常被检测到的共突变基因。KRAS G12C突变亚组和KRAS G12D突变亚组中TP53共突变的发生率相当,而STK11突变在KRAS G12D突变亚组中更常被观察到。其他研究报告称,KRAS G12C突变患者中STK11共突变的发生率更高。需要注意的是,在本研究的队列中,由于各研究点使用的二代测序(NGS)检测panel存在差异,86%的患者无法确定其共突变状态。因此,这些研究结果只是探索性的,需要进一步的研究来验证这些观察结果。
这项研究的一个关键优势在于使用了基于常规临床场景的真实世界数据,这使得研究结果更能推广应用于更广泛的患者群体。与有着严格纳入/排除标准的随机对照试验不同,本研究纳入了多样的患者群体(例如老年人、患有合并症的患者),而这些患者往往会被排除在试验之外。然而,本研究也存在一些局限性。其回顾性研究设计引入了潜在的偏倚,比如部分患者PD-L1表达数据的缺失,这可能会对分析结果产生影响。此外,样本量较小,尤其是KRAS G12D突变患者的样本量,限制了检测细微差异的统计效能。最后,由于本研究具有探索性质,未进行多重检验校正,因此本研究结果只是提出了假设,需要未来的前瞻性研究来加以证实。
本研究为了解携带KRAS G12C和KRAS G12D突变的NSCLC患者的临床特征及治疗结局提供了来自真实世界的见解。尽管这两种突变类型的患者在生存结局方面相当,但携带KRAS G12D突变的患者中从不吸烟的比例更高,且在治疗效果方面存在差异。这些发现强调了持续研发靶向治疗药物的必要性,尤其是针对KRAS G12D突变的药物,以满足这一亚组患者尚未被满足的需求。未来的研究应聚焦于更大规模的前瞻性队列研究,以验证这些发现,并优化针对KRAS驱动的NSCLC的治疗策略。
参考文献:
Shahnam A, Davis A, Brown LJ, et al. Real-World outcomes of Non-Small cell lung cancer patients harbouring KRAS G12C and KRAS G12D mutations. Lung Cancer. Published online February 12, 2025. doi:10.1016/j.lungcan.2025.108421
不感兴趣
看过了
取消

人点赞

人收藏

打赏
不感兴趣
看过了
取消

打赏金额
认可我就打赏我~
1元 5元 10元 20元 50元 其它
打赏作者
认可我就打赏我~
扫描二维码
立即打赏给Ta吧!
温馨提示:仅支持微信支付!
已收到您的咨询诉求 我们会尽快联系您
